《2022年高考化學(xué)一輪復(fù)習(xí) 第七章 第二節(jié) 水溶液 酸堿中和滴定》由會(huì)員分享����,可在線閱讀,更多相關(guān)《2022年高考化學(xué)一輪復(fù)習(xí) 第七章 第二節(jié) 水溶液 酸堿中和滴定(6頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索�。
1、2022年高考化學(xué)一輪復(fù)習(xí) 第七章 第二節(jié) 水溶液 酸堿中和滴定
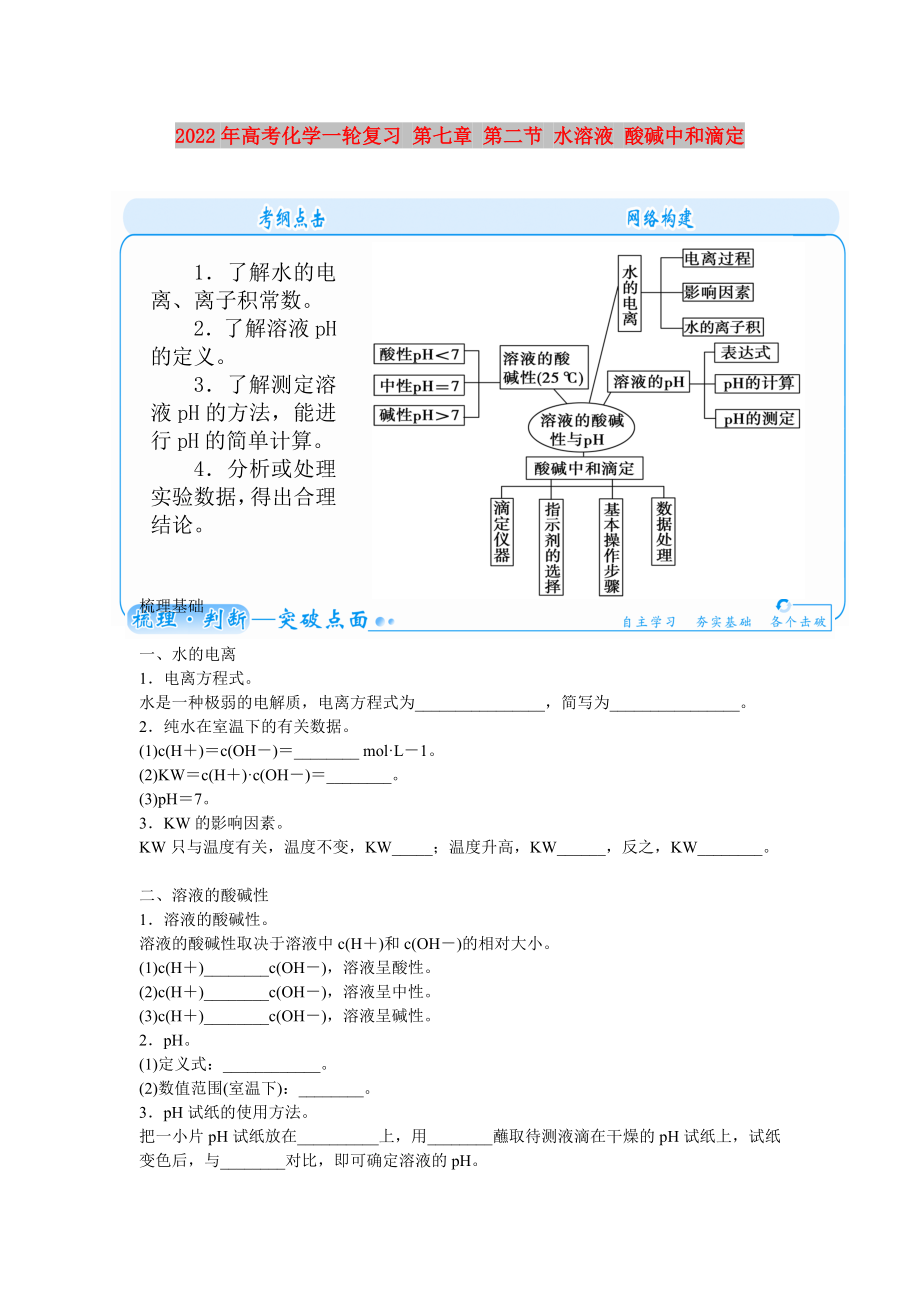
1.了解水的電離�、離子積常數(shù)。
2.了解溶液pH的定義����。
3.了解測(cè)定溶液pH的方法��,能進(jìn)行pH的簡(jiǎn)單計(jì)算�����。
4.分析或處理實(shí)驗(yàn)數(shù)據(jù)�����,得出合理結(jié)論�����。
梳理基礎(chǔ)
一���、水的電離
1.電離方程式。
水是一種極弱的電解質(zhì)�,電離方程式為_(kāi)_______________,簡(jiǎn)寫為_(kāi)_______________�����。
2.純水在室溫下的有關(guān)數(shù)據(jù)��。
(1)c(H+)=c(OH-)=________ mol·L-1��。
(2)KW=c(H+)·c(
2�、OH-)=________。
(3)pH=7��。
3.KW的影響因素��。
KW只與溫度有關(guān)�,溫度不變,KW_____���;溫度升高���,KW______,反之�����,KW________��。
二����、溶液的酸堿性
1.溶液的酸堿性。
溶液的酸堿性取決于溶液中c(H+)和c(OH-)的相對(duì)大小�����。
(1)c(H+)________c(OH-),溶液呈酸性���。
(2)c(H+)________c(OH-)�,溶液呈中性��。
(3)c(H+)________c(OH-)�,溶液呈堿性。
2.pH���。
(1)定義式:____________���。
(2)數(shù)值范圍(室溫下):________。
3.pH試紙的使用
3���、方法����。
把一小片pH試紙放在__________上�����,用________蘸取待測(cè)液滴在干燥的pH試紙上,試紙變色后�����,與________對(duì)比�,即可確定溶液的pH�。
4.pH簡(jiǎn)單計(jì)算:
解答有關(guān)pH的計(jì)算時(shí),首先要注意溫度��,明確是25℃還是非25℃��,然后判斷溶液的酸堿性���,再根據(jù)“酸按酸”��,“堿按堿”的原則進(jìn)行計(jì)算����。
(1)強(qiáng)酸溶液:如濃度為c mol/L的HnA溶液���,c(H+)=_______�,所以pH=________。,
(2)強(qiáng)堿溶液:如濃度為c mol/L的B(OH)n溶液���,c(OH-)=________�,c(H+)=___________�����,所以pH=________�����。
(3)酸
4�、堿混合溶液pH的計(jì)算:兩強(qiáng)酸溶液混合:c混(H+)=_________;兩強(qiáng)堿溶液混合:c混(OH-)=________________���;強(qiáng)酸�����、強(qiáng)堿溶液混合:若酸過(guò)量:c混(H+)=______________�����,若堿過(guò)量:c混(OH-)=_______________����。
(4)酸堿溶液稀釋時(shí)pH的變化:
三、酸堿中和滴定
1.概念�����。
利用________反應(yīng)��,用已知濃度的________來(lái)測(cè)定未知濃度的________的實(shí)驗(yàn)方法����。
2.用品�。
試劑:________、________��、________�����、蒸餾水�。
儀器:________滴定管、________滴定管�、滴定管
5、夾���、鐵架臺(tái)����、燒杯、________���。
3.操作(以用標(biāo)準(zhǔn)鹽酸滴定待測(cè)NaOH溶液為例)��。
(1)滴定前的準(zhǔn)備����。
①滴定管:a.查漏���,b.洗滌����,c.潤(rùn)洗��,d.裝液���,e.排氣��,f.調(diào)液面�,g.記錄。
②錐形瓶:a.注堿液���,b.記讀數(shù)�����,c.加指示劑����。
(2)滴定����。
左手________�����,右手__________��,眼睛注視___________�����,滴定至終點(diǎn)時(shí)���,記錄標(biāo)準(zhǔn)液的體積����。
4.?dāng)?shù)據(jù)處理。
將上述操作重復(fù)2~3次�����,求出用去標(biāo)準(zhǔn)鹽酸體積的平均值��,根據(jù)c(NaOH)=計(jì)算�����。
答案:梳理基礎(chǔ)
一�����、
1.H2O+H2OH3O++OH- H2OH++OH-
2.(1)10-7
6�����、 (2)10-14
3.不變 增大 減小
二����、
1.(1)> (2)= (3)<
2.(1)pH=-lgc(H+) (2)1~14
3.干凈玻璃片 玻璃棒 標(biāo)準(zhǔn)比色卡
4.(1)nc mol·L-1?��。璴g nc (2)nc mol·L-1 mol·L-1 14+lg nc (3)
三、
1.中和 酸(或堿) 堿(或酸)
2.標(biāo)準(zhǔn)溶液 待測(cè)溶液 酸堿指示劑 酸式 堿式 錐形瓶
3.(2)控制活塞 不斷地?fù)u動(dòng)錐形瓶 錐形瓶中溶液顏色的變化
判斷正誤
正確的打“√”��,錯(cuò)誤的打“×”�。
1.25 ℃與60 ℃時(shí),水的p
7�、H相等( )
解析:水的離子積常數(shù)隨溫度的升高而增大,對(duì)應(yīng)pH隨溫度升高而減小�,錯(cuò)誤。
答案:×
2.用0.200 0 mol/L NaOH標(biāo)準(zhǔn)溶液滴定HCl與CH3COOH的混合液(混合液中兩種酸的濃度均約為0.1 mol/L)�����,至中性時(shí)����,溶液中的酸未被完全中和( )
解析:若恰好完全反應(yīng)����,生成NaCl和CH3COONa,呈堿性���,要使溶液呈中性����,則酸過(guò)量,所以沒(méi)有完全中和����,正確。
答案:√
3.稀醋酸加水稀釋����,醋酸電離程度增大,溶液的pH減小( )
解析:稀醋酸加水稀釋�,電離平衡正向移動(dòng),醋酸電離程度增大���,c(H+)減小���,pH增大,錯(cuò)誤���。
答案:×
8�����、
4.同濃度��、同體積的強(qiáng)酸與強(qiáng)堿溶液混合后���,溶液的pH=7( )
解析:不知強(qiáng)酸�����、強(qiáng)堿是幾元酸�����、幾元堿而無(wú)法判斷混合溶液的pH���,如同濃度、同體積的H2SO4與NaOH溶液混合后溶液pH<7�,錯(cuò)誤。
答案:×
5.25℃時(shí)NH4Cl溶液的KW大于100 ℃時(shí)NaCl溶液的KW( )
解析:水的離子積常數(shù)KW只與溫度有關(guān)���,溫度越高,KW越大���,錯(cuò)誤��。
答案:×
6.100℃時(shí)��,將pH=2的鹽酸與pH=12的NaOH溶液等體積混合��,溶液顯中性( )
解析:100℃時(shí)�,水的離子積常數(shù)KW=1×10-12,所以將pH=2的鹽酸與pH=12的NaOH溶液等體積混合
9����、后,溶液顯堿性����,錯(cuò)誤。
答案:×
7.用水濕潤(rùn)pH試紙測(cè)量某溶液的pH( )
解析:pH試紙使用時(shí)不能潤(rùn)濕����,錯(cuò)誤。
答案:×
8.將濃度為0.1 mol·L-1HF溶液加水不斷稀釋�,始終保持增大( )
解析:加水不斷稀釋的過(guò)程中,HF的電離程度不斷增大�,H+的數(shù)目不斷增多,HF分子數(shù)目不斷減少���,始終保持增大�,正確。
答案:√
9.對(duì)滴有酚酞試液的CH3COONa溶液加熱��,溶液顏色變深( )
解析:CH3COONa水解是吸熱反應(yīng)�����,升高溫度��,水解平衡右移�����,堿性增強(qiáng)��,溶液顏色變深�����,正確����。
答案:√
1.(xx·廣州一模)對(duì)于
10、常溫下0.1 mol·L氨水和0.1 mol·L-1核醋酸��,下列說(shuō)法正確的是( )
A.0.1 mol·L-1氨水����,溶液的pH=13
B.0.1 mol·L-1氨水加水稀釋,溶液中c(H+)和c(OH-)都減小
C.0.1 mol·L-1醋酸溶液中�����;c(H+)=c(CH2COO-)
D.0.1 mol·L-1醋酸與0.1 mol·L-1NaOH溶液等體積混合所得溶液中:
c(Na+)>c(CH2COO-)>c(OH-)>c(H-)
答案:D
2.室溫下����,水的電離達(dá)到平衡:H2OH++OH-。下列敘述正確的是( )
A.將水加熱�����,平衡正向移動(dòng)���,KW變小
B.向水
11�、中加入少量NaOH固體��,平衡逆向移動(dòng)���,c(OH-)增大
C.新制氯水久置后�,水的電離平衡正向移動(dòng)�����,c(OH-)增大
D.向水中加入少量CH3COONa固體,平衡正向移動(dòng)��,KW 增大
解析:A項(xiàng)�,加熱后KW變大,不正確�����;C項(xiàng)����,新制氯水久置后,水的電離平衡向左移動(dòng)�����,c(OH-)減小�����,不正確��;D項(xiàng)��,KW不變,不正確�����。
答案:B
3.下列液體均處于25 ℃��,有關(guān)敘述正確的是( )
A.某物質(zhì)的溶液pH<7��,則該物質(zhì)一定是酸或強(qiáng)酸弱堿鹽
B.pH=10的氨水中c(H+)是pH=12的氫氧化鈉溶液中c(H+)的100倍
C.加酸或加堿可使水的離子積減小
D.中和相同濃度的強(qiáng)酸
12�、與弱酸�,弱酸所消耗的堿多
解析:A項(xiàng),該物質(zhì)也可能是NaHSO4這種鹽����,不正確;B項(xiàng)正確����;C項(xiàng),加酸或加堿�����,相同溫度下水的離子積不變��,不正確;D項(xiàng)�,中和相同濃度的強(qiáng)酸與弱酸,若兩者均為一元酸�,則兩者消耗的堿一樣多����,不正確。
答案:B
4.室溫下���,將一元酸HA的溶液和KOH溶液等體積混合(忽略體積變化)���,實(shí)驗(yàn)數(shù)據(jù)如下表:
下列判斷不正確的是( )
解析:由實(shí)驗(yàn)①可知,HA酸為弱酸���,故KA鹽溶液顯堿性,則c(OH-)>c(H+)����,由電荷守恒可知c(K+)>c(A-),故A正確��;由電荷守恒知c(K+)+c(H+)=c(OH-)+c(A-),故c(OH-)= c(K+)-c
13�、(A-)+c(H+),故B錯(cuò)誤�����;由實(shí)驗(yàn)②知x>0.2���,故c(HA)+ c(A-)>0.1 mol·L-1(因?yàn)槿芤后w積是原溶液的2倍),故C正確����;實(shí)驗(yàn)②反應(yīng)后的溶液顯中性���,故c(OH-)=c(H+)�,由電荷守恒可得c(K+)=c(A-)�,故D正確。
答案:B
5.用中和滴定法測(cè)定某燒堿樣品的純度����,試根據(jù)實(shí)驗(yàn)回答下列問(wèn)題:
(1)準(zhǔn)確稱量8.2 g含有少量中性易溶雜質(zhì)的樣品,配成500 mL待測(cè)溶液��。稱量時(shí),樣品可放在________(填編號(hào)字母)稱量��。
A.小燒杯中 B.潔凈紙片上 C.托盤上
(2)滴定時(shí)��,用0.200 0 mol·L-1的鹽酸來(lái)滴定待測(cè)溶液�,不可選用___
14、_____(填編號(hào)字母)作指示劑�����。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定過(guò)程中���,眼睛應(yīng)注視__________________�;在鐵架臺(tái)上墊一張白紙���,其目的是_____________________�����。
(4)根據(jù)下表數(shù)據(jù)�����,計(jì)算被測(cè)燒堿溶液的物質(zhì)的量濃度是________mol·L-1�����,燒堿樣品的純度是_______________���。
(5)下列實(shí)驗(yàn)操作會(huì)對(duì)滴定結(jié)果產(chǎn)生什么影響(填“偏高”����、“偏低”或“無(wú)影響”)?
①觀察酸式滴定管液面時(shí)����,開(kāi)始俯視�,滴定終點(diǎn)平視,則滴定結(jié)果________��。
②若將錐形瓶用待測(cè)液潤(rùn)洗�����,然后再加入10.00 mL待測(cè)液�,則滴定結(jié)果________。
解析:(1)稱量氫氧化鈉等易潮解���、腐蝕性強(qiáng)的試劑時(shí)��,樣品應(yīng)放在小燒杯中����;(2)酸堿中和滴定時(shí),一般應(yīng)選甲基橙�����、酚酞等顏色變化較明顯的指示劑��,石蕊在酸或堿溶液中顏色比較深��,顏色變化不明顯�����,易造成誤差���;(4)根據(jù)c(待測(cè))=分別求第1��、2次的值�����,再求平均值����,解得c(NaOH)=0.400 0 mol·L-1;(5)①中V(標(biāo)準(zhǔn))偏大��,故c(待測(cè))偏高����;②中V(標(biāo)準(zhǔn))偏大,c(待測(cè))也偏高�。
答案:(1)A (2)B (3)錐形瓶?jī)?nèi)溶液顏色的變化 便于觀察錐形瓶?jī)?nèi)液體顏色的變化,減小滴定誤差
(4)0.400 0 97.56% (5)①偏高?����、谄?
 2022年高考化學(xué)一輪復(fù)習(xí) 第七章 第二節(jié) 水溶液 酸堿中和滴定
2022年高考化學(xué)一輪復(fù)習(xí) 第七章 第二節(jié) 水溶液 酸堿中和滴定