《九年級化學(xué)《金屬與金屬材料》復(fù)習(xí)學(xué)案 人教新課標(biāo)版》由會員分享�,可在線閱讀,更多相關(guān)《九年級化學(xué)《金屬與金屬材料》復(fù)習(xí)學(xué)案 人教新課標(biāo)版(4頁珍藏版)》請在裝配圖網(wǎng)上搜索�。
1、九年級化學(xué)《金屬與金屬材料》復(fù)習(xí)學(xué)案 人教新課標(biāo)版
一�、【復(fù)習(xí)目標(biāo)】
1、了解金屬的物理特征
2�、掌握金屬的化學(xué)性質(zhì)
3、了解金屬銹蝕條件及防銹措施
二�、【復(fù)習(xí)重點�、難點】
1�、金屬的化學(xué)性質(zhì)
2、金屬活動性順序表的應(yīng)用
3. 含雜計算
【復(fù)習(xí)過程】
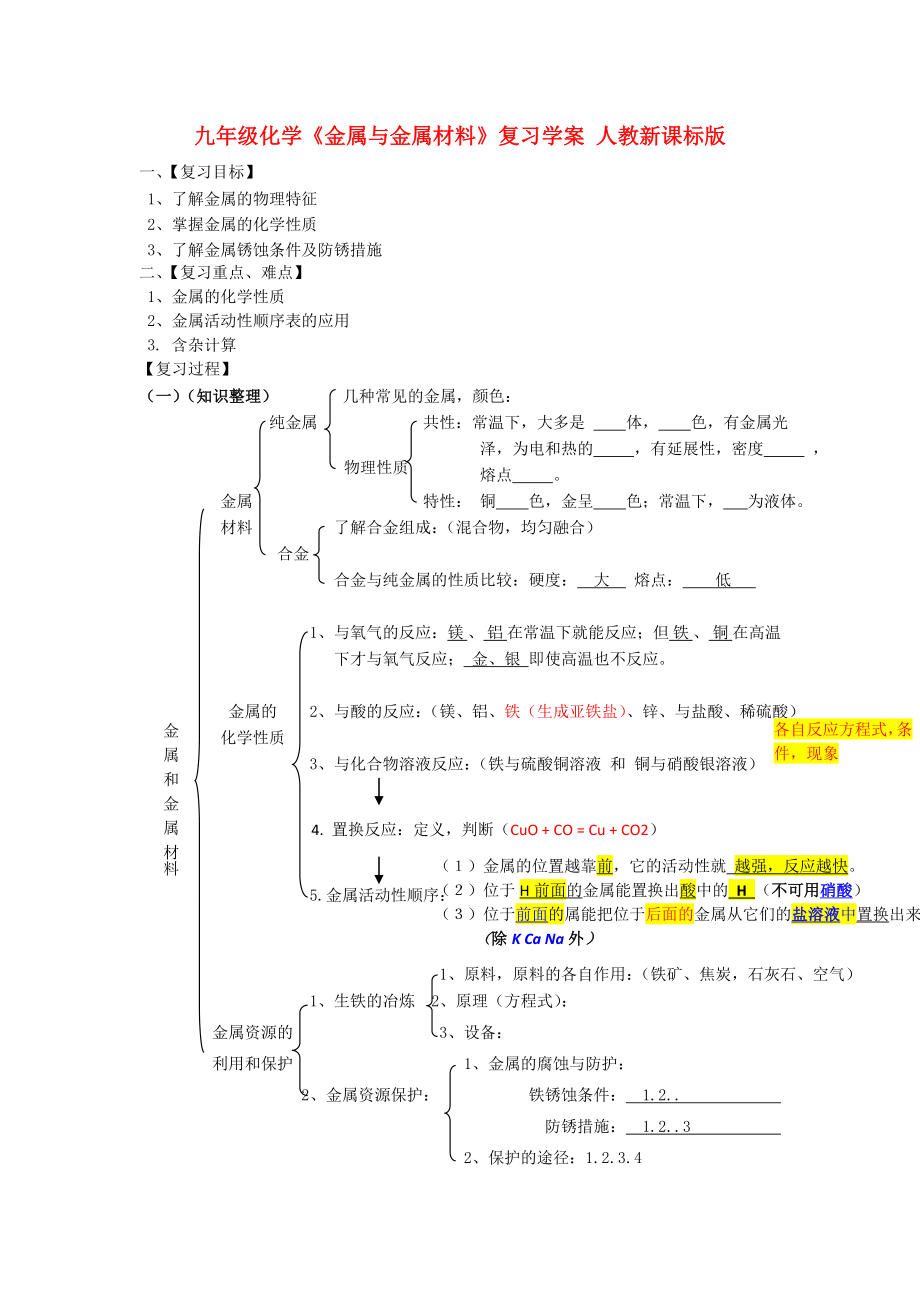
(一)(知識整理) 幾種常見的金屬�,顏色:
物理性質(zhì)
純金屬 共性:常溫下,大多是 體�, 色,有金屬光澤�,為電和熱的 ,有延展性�,密度 , 熔點 �。
金屬 特性: 銅 色,金呈 色�;常溫
2、下�, 為液體。
材料 了解合金組成:(混合物�,均勻融合)
合金
合金與純金屬的性質(zhì)比較:硬度: 大 熔點: 低
1、與氧氣的反應(yīng):鎂 �、 鋁 在常溫下就能反應(yīng);但 鐵 �、 銅 在高溫下才與氧氣反應(yīng); 金�、銀 即使高溫也不反應(yīng)。
各自反應(yīng)方程式,條件�,現(xiàn)象
金 屬 和 金 屬 材料
金屬的 2、與酸的反應(yīng):(鎂�、鋁、鐵(生成亞鐵鹽)�、鋅、與鹽酸�、稀硫酸)
化學(xué)性質(zhì)
3、與化
3�、合物溶液反應(yīng):(鐵與硫酸銅溶液 和 銅與硝酸銀溶液)
4. 置換反應(yīng):定義,判斷(CuO + CO = Cu + CO2)
(1)金屬的位置越靠前�,它的活動性就 越強(qiáng),反應(yīng)越快�。
(2)位于H前面的金屬能置換出酸中的 H (不可用硝酸)
(3)位于前面的屬能把位于后面的金屬從它們的鹽溶液中置換出來。
(除K Ca Na外)
5.金屬活動性順序:
1�、原料,原料的各自作用
4�、:(鐵礦、焦炭�,石灰石�、空氣)
1、生鐵的冶煉 2�、原理(方程式):
金屬資源的 3、設(shè)備:
利用和保護(hù) 1�、金屬的腐蝕與防護(hù):
2、金屬資源保護(hù): 鐵銹蝕條件: 1.2..
防銹措施: 1.2..3
2、 保護(hù)的途徑:1.2.3.4
5�、含雜質(zhì)化學(xué)反應(yīng)的計算
(1).純凈物與含雜質(zhì)物質(zhì)的換算關(guān)系:
×純物質(zhì)質(zhì)量分?jǐn)?shù)
÷純物質(zhì)質(zhì)量分?jǐn)?shù)
含雜質(zhì)物質(zhì)的質(zhì)量 純凈物質(zhì)的質(zhì)量
純凈物質(zhì)量
混合物質(zhì)量
物質(zhì)純度= ×100% =1-雜質(zhì)的質(zhì)量分?jǐn)?shù)
例:某煉鐵廠用含氧化鐵80%的赤鐵礦冶煉生鐵。若要煉出1120t含鐵95%的生鐵�,需要含氧化鐵80%的赤鐵礦多少噸?
1. 求純
2. 設(shè)未知數(shù)
3. 寫化學(xué)方程式
4. 寫出有關(guān)式量�、
6、已知量和
未知量
5. 列比例式�,求解
6. 簡明寫出答案
實驗:
一氧化碳還原氧化鐵
⑴儀器裝置:鐵架臺(2個)、硬質(zhì)玻璃管�、單孔橡皮賽(2個)、酒精燈�、試管、酒精噴燈�、雙孔橡皮賽、導(dǎo)氣管�。
⑵步驟:①檢驗裝置的氣密性;②裝入藥品并固定�; ③向玻璃管內(nèi)通入一氧化碳?xì)怏w;④給氧化鐵加熱�;⑤停止加熱;⑥停止通入一氧化碳�。
⑶現(xiàn)象:紅色粉末變__________________,澄清石灰水變________�,尾氣燃燒產(chǎn)生
________色火焰。
⑷化學(xué)方程式:
3CO+ Fe2O3高溫2Fe +
7�、 3CO2
Ca(OH)2+CO2=CaCO3↓+H2O
2CO + O2點燃 2CO2。
⑸注意事項:與CO還原氧化銅的實驗操作順序一樣,即先通入CO再加熱�,實驗完畢,停止加熱�,繼續(xù)通入CO至試管冷卻。
⑹尾氣處理:因CO有毒�,不能隨意排放在空氣中,處理的原則是將CO燃燒掉轉(zhuǎn)化為無毒的CO2或收集備用�。
(二)、(簡單運(yùn)用)
1.xx年上海世博會中國館—“東方之冠”給人強(qiáng)烈的視覺沖擊�,它的主體結(jié)構(gòu)為四根巨型鋼筋混凝上制成的陔心筒。其中鋼屬于( )
A.金屬材料 B.合成材料 C.天然材料 D.復(fù)合材料
2. 鋁�、銅
8、�、鐵、金四種金屬具有相似的性質(zhì)是( )
A.都是銀白色的固體 B.有導(dǎo)電性
C.能和稀硫酸反應(yīng) D.通常狀況下能與氧氣反應(yīng)
3. “金銀銅鐵錫”俗稱五金�。在這五種金屬中,金屬活動性最強(qiáng)的是( )
A.鐵 B.金 C.銀 D.銅
4. 將甲�、乙兩種金屬片分別放入丙的硫酸鹽溶液中,甲表面有金屬丙析出�,乙表面沒有任何變化。據(jù)此判斷�,三種金屬的活動性順序是 ( )
A.甲>丙>乙 B.丙>甲>乙 C.乙>甲>丙
9、 D.甲>乙>丙
5.下列反應(yīng)中�,屬于置換反應(yīng)的是( )
A. 2H2O2 = 2H2O+ O2↑ B. CuO+CO = Cu+CO2
C. H2+CuO = Cu+H2O D. CO2+H2O = H2CO3
6.下列化學(xué)方程式書寫正確的是( )
A. 4Fe+3O22Fe2O3 B.2Fe+6HCl=2FeCl3+3H2↑
C.Al + CuS04== AlSO4 + Cu D. Fe2O3+3CO2Fe+3CO2
7.判斷下列物質(zhì)能否發(fā)生反應(yīng)�?若能,寫出相關(guān)化學(xué)方程式
(
10、1)銀與稀鹽酸
(2)鋅與硫酸銅溶液
(3)銅與硫酸鋅溶液
(4)鋁與硝酸銀溶液
(5)銀與氯化銅溶液
(6)鎂與硫酸亞鐵溶液
8. 某鋼鐵廠高爐煉鐵的主要反應(yīng)過程如下:
過量空氣�、高溫
①
焦炭、高溫
②
赤鐵礦�、高溫
③
生鐵
焦炭
(1)請在方框內(nèi)填入相應(yīng)物質(zhì)的化學(xué)式。
(2)寫出步驟①②③的化學(xué)方程式:①
② ③
11�、
(3)從高爐上排出的廢氣叫高爐廢氣,請推測高爐廢氣的主要成份為 �。
9.根據(jù)你的生活經(jīng)驗,回答下列問題:
(1)家用鐵鍋除了硬度較大外�,還利用了鐵具有 這一性質(zhì);
(2)在木材上釘釘一般用鐵釘�,在水泥墻上釘釘一般用鋼釘,這是由于鐵和鋼的 不同�;
(3)銅的導(dǎo)電性強(qiáng)于鋁,而高壓輸電一般用鋁線不用銅線的原因是(只要能答出一個理由就可以) �;
(4)燈泡中的燈絲一般用的是 ,你能說出不用錫制的原因嗎�? ;
練習(xí).
1�、
12、在氯化銅和氯化亞鐵的混合溶液中加入一定量的鎂粉�,充分反應(yīng)后過濾,向濾出的固體中滴加稀鹽酸�,沒有氣泡產(chǎn)生。下列判斷正確的是( )
A.濾出的固體中一定含有銅�,可能含有鐵和鎂
B.濾出的固體一定含有銅�,一定不含鐵和鎂
C.濾液中一定含有氯化鎂和氯化亞鐵�,可能含有氯化銅
D.濾液中一定含有氯化鎂、氯化亞鐵�、氯化銅
2、 燒杯中盛有質(zhì)量相等�、質(zhì)量分?jǐn)?shù)相等的稀鹽酸,天平調(diào)平后�,同時向其中分別加入等質(zhì)量的鋅片和鐵片,則從反應(yīng)開始到金屬完全反應(yīng)的過程中�,天平指針指向的變化是( )
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左
13、
1�、下列化合物可以通過金屬與對應(yīng)的酸發(fā)生置換反應(yīng)獲得的是( )
A.CuCl2 B.FeCl3 C.AgNO3 D.Al2 (SO4) 3
3、 有甲�、乙、丙�、丁四種金屬。只有甲在自然界主要以游離態(tài)存在�。丁鹽的水溶液不能用乙制的容器盛放,但可以用丙制的容器盛放�。這四種金屬的活動性由強(qiáng)到弱的順序是( )
A.甲>乙>丁>丙 B.丙>?。疽遥炯?
C.丙>乙>丁>甲 D.乙>?。颈炯?
4、有AgNO3�、Cu(NO3)2�、Zn(NO3)2的混合溶液中加人一定量的鐵粉�,使其充分反應(yīng)后�,過濾,向濾渣中滴加稀鹽酸�,有氣泡產(chǎn)生,
14�、則下列結(jié)論正確的是( )
A .濾液中一定含Ag+、Cu2+�、Zn2+、Fe2+
B .濾液中一定含F(xiàn)e2+ �,可能含Zn2+
C .濾液中一定含F(xiàn)e2+ ,Zn2+,不含Cu2+,Ag+
D .濾液中一定含Zn2+、Fe2+,可能含Cu2+
5�、CuCl2和MgCl2 的混合溶液中,加入過量的鐵粉�,充分反應(yīng)后過濾,所得固體為 �。
6、用質(zhì)量相等的鎂和鐵分別和質(zhì)量相等�、溶質(zhì)質(zhì)量分?jǐn)?shù)也相等的稀鹽酸充分反應(yīng),最終產(chǎn)生氫氣的質(zhì)量相等�,則上述物質(zhì)中一定恰好完全反應(yīng)的是 , 金屬一定有剩余�。
10.某鋼鐵廠每天需消耗5000t含F(xiàn)e2O376%的赤鐵礦,該廠理論上可日產(chǎn)含F(xiàn)e98%的生鐵的質(zhì)量是多少�?
 九年級化學(xué)《金屬與金屬材料》復(fù)習(xí)學(xué)案 人教新課標(biāo)版
九年級化學(xué)《金屬與金屬材料》復(fù)習(xí)學(xué)案 人教新課標(biāo)版