《2022-2023學年高中化學(課堂同步系列二)每日一題 每周一測2(含解析)新人教版選修4》由會員分享���,可在線閱讀����,更多相關(guān)《2022-2023學年高中化學(課堂同步系列二)每日一題 每周一測2(含解析)新人教版選修4(6頁珍藏版)》請在裝配圖網(wǎng)上搜索�����。
1��、2022-2023學年高中化學(課堂同步系列二)每日一題 每周一測2(含解析)新人教版選修4
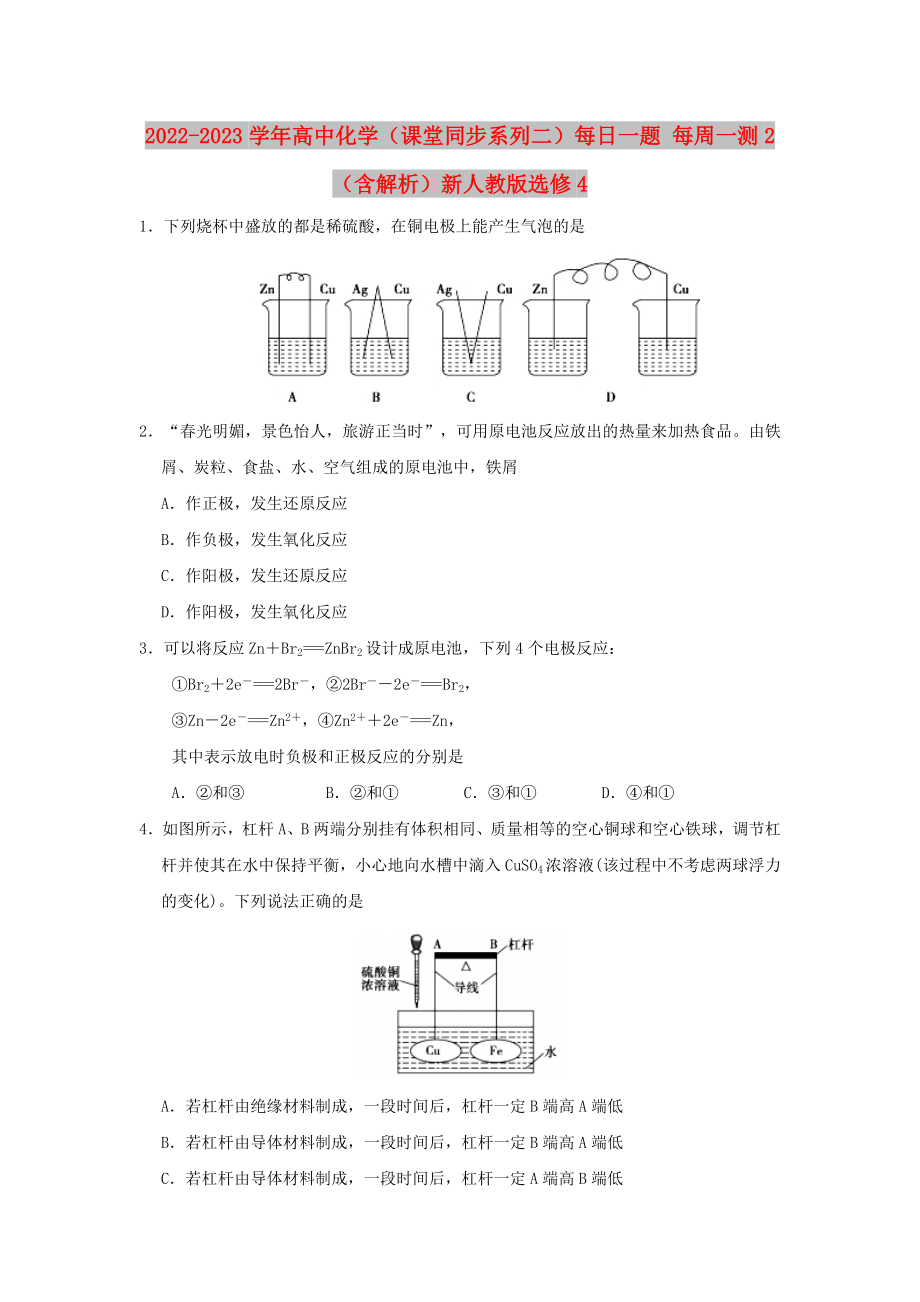
1.下列燒杯中盛放的都是稀硫酸����,在銅電極上能產(chǎn)生氣泡的是
2.“春光明媚,景色怡人�,旅游正當時”,可用原電池反應放出的熱量來加熱食品��。由鐵屑�、炭粒、食鹽�、水��、空氣組成的原電池中�,鐵屑
A.作正極���,發(fā)生還原反應
B.作負極����,發(fā)生氧化反應
C.作陽極�����,發(fā)生還原反應
D.作陽極����,發(fā)生氧化反應
3.可以將反應Zn+Br2===ZnBr2設計成原電池,下列4個電極反應:
①Br2+2e-===2Br-�,②2Br--2e-===Br2�,
③Zn-2e-===Zn2+,④Zn2++2e-==
2���、=Zn����,
其中表示放電時負極和正極反應的分別是
A.②和③ B.②和① C.③和① D.④和①
4.如圖所示,杠桿A��、B兩端分別掛有體積相同�����、質(zhì)量相等的空心銅球和空心鐵球����,調(diào)節(jié)杠桿并使其在水中保持平衡,小心地向水槽中滴入CuSO4濃溶液(該過程中不考慮兩球浮力的變化)����。下列說法正確的是
A.若杠桿由絕緣材料制成,一段時間后���,杠桿一定B端高A端低
B.若杠桿由導體材料制成�,一段時間后��,杠桿一定B端高A端低
C.若杠桿由導體材料制成���,一段時間后���,杠桿一定A端高B端低
D.無論杠桿由絕緣材料還是由導體材料制成���,一段時間后,杠桿一定A端
3����、高B端低
5.某同學根據(jù)化學反應Fe+2Fe3+3Fe2+,利用實驗室材料組裝原電池����。則該原電池的組成及現(xiàn)象正確的是
A
B
C
D
正極
碳棒
碳棒
鐵棒
碳棒
負極
鐵棒
鐵棒
鋅片
鐵棒
電解質(zhì)溶液
FeCl3
FeCl3
H2SO4
FeCl2
現(xiàn)象
鐵棒變細,碳棒周圍
溶液顏色變淺
鐵棒變細���,
碳棒變粗
鋅棒變細��,
鐵棒變粗
鐵棒變細����,
碳棒不變
6.已知:Ksp(CuS)=1.3×10-36mol2/L2����,Ksp(MnS)=2.6×10-13mol2/L2。工業(yè)生產(chǎn)中常用MnS作為沉淀劑除去工業(yè)廢水中的Cu2+:Cu2
4���、+(aq)+MnS(s) CuS(s)+Mn2+(aq)�����,下列說法錯誤的是
A.MnS使用量越大��,廢水中的Cu2+的去除率越高
B.該反應可將工業(yè)廢水中的Cu2+沉淀完全
C.往平衡體系中加入少量CuSO4固體后�����,c(Mn2+)變大
D.該反應的平衡常數(shù)K=2.0×1023
7.控制適宜條件���,將反應Sn(s)+Pb2+ (aq)Sn2+ (aq)+Pb(s) ΔH<0,設計成如圖所示的原電池�����,一段時間后�����,電流表讀數(shù)為零���。則下列判斷不正確的是
A.此時化學反應達到平衡狀態(tài)
B.若此時將Sn電極換成質(zhì)量較大的Sn 電極后����,電流表指針偏轉(zhuǎn),c(Pb2+)將減小
C.若此時向左池
5�����、加入少量的Sn(NO3)2固體���,電流表指針偏轉(zhuǎn)��,Sn電極為正極
D.若此時升高溫度���,c(Sn2+)將減小,Pb電極為負極
8.依據(jù)氧化還原反應:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)設計的原電池��,如圖所示�����。
CuSO4溶液 Y
請回答下列問題:
(1)電極X的材料是______�;電解質(zhì)溶液Y是_________________________。
(2)銀電極為電池的________極�,發(fā)生的電極反應為____________________。X電極上發(fā)生的電極反應為___________________________�。
(3)外電路中的
6、電子是從______極流向______極。
9.某?;瘜W研究性學習小組欲設計實驗驗證Fe��、Cu的金屬活動性��,他們提出了以下兩種方案�����。請你幫助他們完成有關(guān)實驗項目���。
方案Ⅰ:有人提出將大小相等的鐵片和銅片�����,分別同時放入稀硫酸(或稀鹽酸)中�����,觀察產(chǎn)生氣泡的快慢�����,據(jù)此確定它們的活動性����。該原理的離子方程式為:_______________________________。
方案Ⅱ:有人利用Fe�����、Cu作電極設計成原電池��,以確定它們的活動性�����。試在下面的方框內(nèi)畫出原電池裝置圖�,標出原電池的電極材料和電解質(zhì)溶液,并寫出電極反應式��。
正極反應式:________________________
7���、____________________________���;
負極反應式:____________________________________________________。
方案Ⅲ:結(jié)合你所學的知識����,幫助他們再設計一個驗證Fe、Cu活動性的簡單實驗方案(與方案Ⅰ、Ⅱ不能雷同):___________________________________________________���,用離子方程式表示其反應原理:________________________________________________����。
10.已知常溫下�,AgBr的Ksp =4. 9×10-13���、AgI的Ksp=8
8�����、. 3×10-17��。
(1)現(xiàn)向含有AgI的飽和溶液中:
① 加入固體AgNO3�����,則c(I-)________(填“變大”“變小”或“不變”���,下同);
② 若加入更多的AgI固體�,則c(Ag+)________;
③ 若加入AgBr固體,則c(I-)________����;而c(Ag+)________。
(2) 有關(guān)難溶鹽的溶度積及溶解度(與AgBr��、AgI無關(guān))����,有以下敘述,其中正確的是________��。
A.兩種難溶鹽電解質(zhì)����,其中Ksp小的溶解度一定小
B.向含有AgCl固體的溶液中加入適量的水使AgCl溶解又達到平衡時,AgCl的溶度積不變�����,其溶解度也不變
C.將難溶電解質(zhì)放
9���、入純水中�����,溶解達到平衡時���,電解質(zhì)離子的濃度的乘積就是該物質(zhì)的溶度積
D.溶液中存在兩種可以與同一沉淀劑生成沉淀的離子���,則Ksp小的一定先生成沉淀
E.難溶鹽電解質(zhì)的Ksp和溫度有關(guān)
F.同離子效應(加入與原電解質(zhì)具有相同離子的物質(zhì)),使難溶鹽電解質(zhì)的溶解度變小���,也使Ksp變小
(3)現(xiàn)向含有NaBr���、KI均為0. 002 mol?L-1的溶液中加入等體積的濃度為4×10-3mol?L-1的AgNO3溶液�,則產(chǎn)生的沉淀是________(填化學式);若向其中再加人適量的NaI固體�����,則最終可發(fā)生沉淀轉(zhuǎn)化的總離子方程式為__________________________________��。
10���、
1.【答案】A
【解析】B�����、C選項均無化學反應��;D選項Zn與稀H2SO4反應���,但裝置不能形成閉合回路�����,只有A符合要求�。
2.【答案】B
【解析】該原電池中鐵作負極���,失電子發(fā)生氧化反應�����;炭粒作正極�����,O2得電子發(fā)生還原反應���。故選B。
3.【答案】C
【解析】放電時負極反應物為Zn�,失電子被氧化�,正極反應物為Br2����,得電子被還原。
4.【答案】B
【解析】若杠桿由絕緣材料制成����,則未形成原電池,只發(fā)生Fe與硫酸銅溶液的反應�����,在空心鐵球表面析出銅�����,質(zhì)量變大���,所以A端高B端低,A錯誤�����;若杠桿由導體材料制成��,則構(gòu)成原電池,空心鐵球作負極�����,空心銅球作正極���,硫酸銅溶液作電解質(zhì)溶液����,空心銅球
11���、上析出銅�,杠桿一定B端高A端低�,C、D錯誤��,B正確��。
6.【答案】A
【解析】本題考查溶解平衡以及沉淀轉(zhuǎn)化的有關(guān)判斷和計算�����。A.MnS是固體�,所以增大使用量�,平衡不移動��,因此MnS使用量越大����,不能增大廢水中的Cu2+的去除率,A錯誤�;B、化學式相似的分子�����,溶度積大的沉淀可以轉(zhuǎn)化為溶度積小的沉淀�,所以根據(jù)轉(zhuǎn)化的方程式可知,MnS的Ksp比CuS的Ksp大�����,故B正確�; C.往平衡體系中加入少量CuSO4固體后�����,溶液中銅離子濃度增大���,平衡正向移動�,所以c(Mn2+)變大,C正確���。D.該反應的平衡常數(shù)K=(2.6×10-13)/(1.3×10-36)=2.0×1023��,D正確�����;故選A�。
7
12�、.【答案】B
【備注】(1)電池的正負極不是一成不變的,當電池反應的方向發(fā)生改變時�,正負極將“易位”。這種情況是針對可逆反應的電池而言的�����。
(2)當原電池反應處于平衡狀態(tài)時��,電流表的讀數(shù)為零���。
8.【答案】 (1)銅(或Cu) AgNO3溶液
(2)正 Ag++e-===Ag Cu-2e-===Cu2+
(3)負(或Cu) 正(或Ag)
【解析】原電池中負極上發(fā)生氧化反應����,正極上發(fā)生還原反應,鹽橋起到形成閉合回路����、平衡電荷的作用。由總反應方程式可知電極X的材料是銅���,發(fā)生氧化反應����,電解質(zhì)溶液Y是可溶性銀鹽溶液�,常用硝酸銀溶液。電極反應式表示為負極:Cu-2e-===Cu2+����,正
13、極:Ag++e-===Ag�����,電子由負極(或Cu)出發(fā)��,經(jīng)外電路流向正極(或Ag)����。
9.【答案】方案Ⅰ:Fe+2H+===Fe2++H2↑
方案Ⅱ:
2H++2e-===H2↑ Fe-2e-===Fe2+
方案Ⅲ:把鐵片插入CuSO4溶液中,一段時間后�����,觀察鐵片表面是否生成紅色物質(zhì)(其他答案合理即可)
Fe+Cu2+===Cu+Fe2+
【解析】 比較或驗證金屬活動性的方案有很多���,可以利用金屬與酸反應的難易來判斷或驗證�,也可利用原電池原理(負極是較活潑的金屬)�,也可利用金屬單質(zhì)間的置換反應來完成。
10.【答案】(1)①變?���、诓蛔儮圩冃? 變大
(2)B、E
(3)AgI����、A
14、gBr AgBr(s) + I-(aq)AgI(s)+Br-(aq)
(2)A項中只有相同類型的難溶電解質(zhì)���, Ksp越小���,溶解度越小��,不同類型的難溶電解質(zhì)不能根據(jù)Ksp判斷溶解度的大小�����, A錯誤��;B項中因濕度不變����,故再次達到平衡時��,Ksp與S均不變����,B正確;Ksp是各離子濃度的冪之積�����,C錯誤����;D項中生成沉淀的先后還與離子的濃度有關(guān)���,D錯誤;E正確�����;同離子效應不會改變Ksp�����, F錯誤���。
(3)等體積混合后c(Br-)= 0. 001 mol?L-1, c(Ag+)=2×10-3mol?L-1�。
I一轉(zhuǎn)化為AgI沉淀所需c(Ag+)=mol?L-1=8.3×10-14mol?L-1。
Br-轉(zhuǎn)化為AgBr沉淀所需c(Ag+)=mol?L-1=4.9×10-10mol?L-1��,故Ag+過量�����,AgI�����、AgBr均沉淀出來,而再向其中加入適量Nal固體時�,會有AgBr轉(zhuǎn)化為AgI。
 2022-2023學年高中化學(課堂同步系列二)每日一題 每周一測2(含解析)新人教版選修4
2022-2023學年高中化學(課堂同步系列二)每日一題 每周一測2(含解析)新人教版選修4