《2020年中考化學(xué)總復(fù)習(xí)教學(xué)案 第五單元課題1 質(zhì)量守恒定律》由會員分享����,可在線閱讀,更多相關(guān)《2020年中考化學(xué)總復(fù)習(xí)教學(xué)案 第五單元課題1 質(zhì)量守恒定律(4頁珍藏版)》請在裝配圖網(wǎng)上搜索�����。
1���、2020年中考化學(xué)總復(fù)習(xí)教學(xué)案
知識·巧學(xué)·升華
一、質(zhì)量守恒定律
1.質(zhì)量守恒定律
參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和等于反應(yīng)后生成的各物質(zhì)的質(zhì)量總和��。這個規(guī)律叫做質(zhì)量守恒定律���。一切化學(xué)反應(yīng)都遵循質(zhì)量守恒定律����。
【實(shí)驗(yàn)探究】
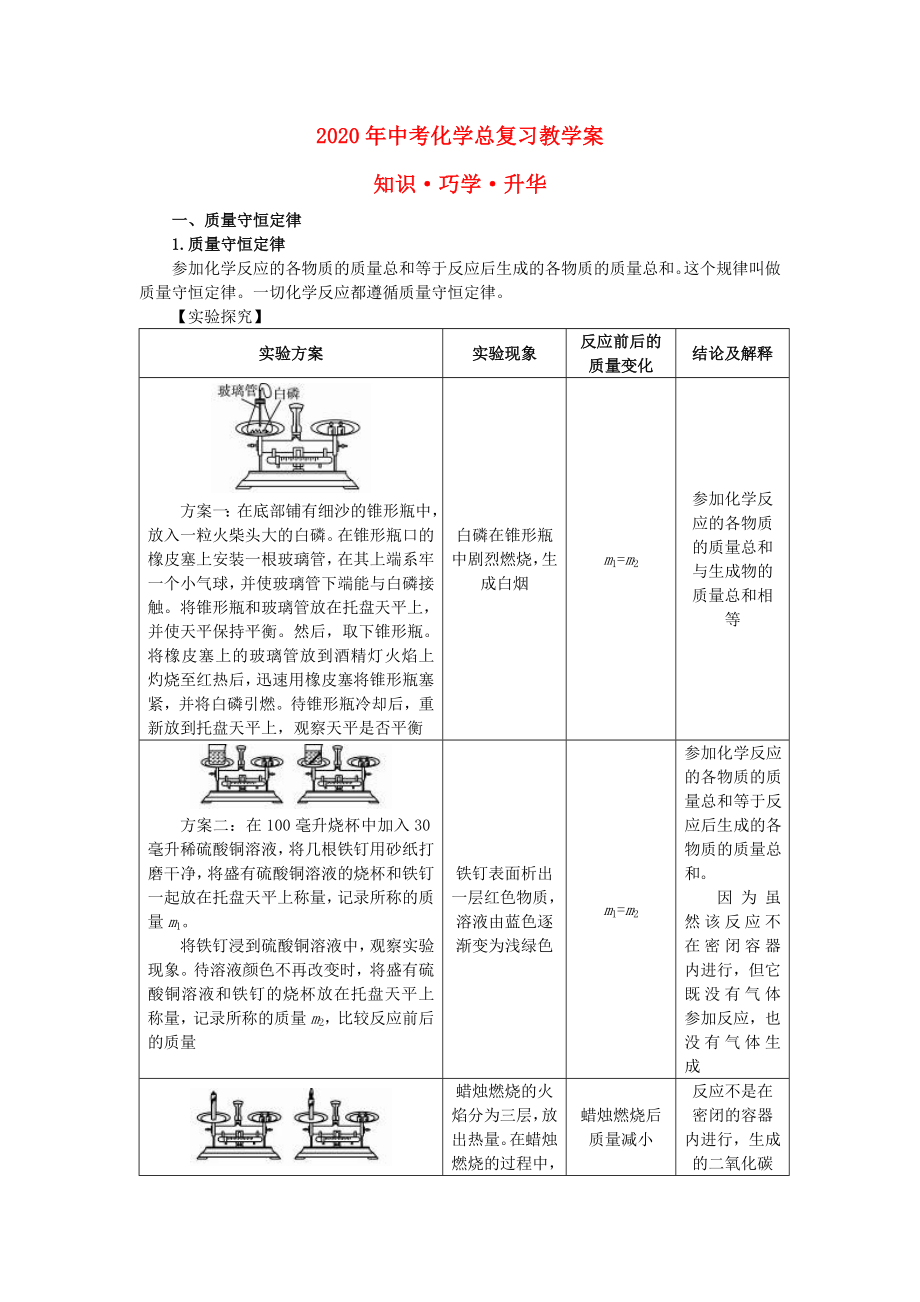
實(shí)驗(yàn)方案
實(shí)驗(yàn)現(xiàn)象
反應(yīng)前后的質(zhì)量變化
結(jié)論及解釋
方案一:在底部鋪有細(xì)沙的錐形瓶中,放入一?�;鸩耦^大的白磷�����。在錐形瓶口的橡皮塞上安裝一根玻璃管��,在其上端系牢一個小氣球�,并使玻璃管下端能與白磷接觸。將錐形瓶和玻璃管放在托盤天平上��,并使天平保持平衡�����。然后��,取下錐形瓶�����。將橡皮塞上的玻璃管放到酒精燈火焰上灼燒至紅熱后��,迅速用橡皮塞將錐形瓶塞緊��,并將白磷引燃
2、�����。待錐形瓶冷卻后�����,重新放到托盤天平上��,觀察天平是否平衡
白磷在錐形瓶中劇烈燃燒�,生成白煙
m1=m2
參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和與生成物的質(zhì)量總和相等
方案二:在100毫升燒杯中加入30毫升稀硫酸銅溶液,將幾根鐵釘用砂紙打磨干凈����,將盛有硫酸銅溶液的燒杯和鐵釘一起放在托盤天平上稱量,記錄所稱的質(zhì)量m1�。
將鐵釘浸到硫酸銅溶液中,觀察實(shí)驗(yàn)現(xiàn)象����。待溶液顏色不再改變時����,將盛有硫酸銅溶液和鐵釘?shù)臒旁谕斜P天平上稱量�,記錄所稱的質(zhì)量m2���,比較反應(yīng)前后的質(zhì)量
鐵釘表面析出一層紅色物質(zhì)����,溶液由藍(lán)色逐漸變?yōu)闇\綠色
m1=m2
參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和等于反應(yīng)后生成的各物質(zhì)的質(zhì)量總
3�、和。
因?yàn)殡m然該反應(yīng)不在密閉容器內(nèi)進(jìn)行���,但它既沒有氣體參加反應(yīng)�,也沒有氣體生成
方案三:取一根蠟燭粘在一小塊玻璃片上���,將玻璃片和蠟燭一起放在托盤天平上����,調(diào)節(jié)天平平衡��,點(diǎn)燃蠟燭�����,觀察天平的平衡情況
蠟燭燃燒的火焰分為三層���,放出熱量����。在蠟燭燃燒的過程中,可看到蠟燭逐漸變短���,天平不再平衡���,指針向右偏轉(zhuǎn)
蠟燭燃燒后質(zhì)量減小
反應(yīng)不是在密閉的容器內(nèi)進(jìn)行,生成的二氧化碳和水蒸氣跑到空氣中去了�����,因而天平不平衡
方法點(diǎn)撥
對質(zhì)量守恒定律的實(shí)驗(yàn)探究����,重點(diǎn)是會設(shè)計實(shí)驗(yàn)方案、描述實(shí)驗(yàn)現(xiàn)象����,能夠根據(jù)實(shí)驗(yàn)現(xiàn)象得到正確的結(jié)論。
2.質(zhì)量守恒的原因(微觀解釋)
因?yàn)榛瘜W(xué)反應(yīng)的過程��,就是參加反應(yīng)的各物質(zhì)
4���、(反應(yīng)物)的原子�����,重新組合而生成其他物質(zhì)(生成物)的過程����。也就是說�����,在化學(xué)反應(yīng)中���,反應(yīng)前后原子的種類沒有改變�,原子的數(shù)目沒有增減���,原子的質(zhì)量也沒有改變�。所以�,反應(yīng)前后各物質(zhì)的質(zhì)量總和相等。
要點(diǎn)提示
①該定律只適用于化學(xué)變化�����,如果不是化學(xué)變化,則不適合該定律���。如5克水在加熱的條件下變成5克水蒸氣符合質(zhì)量守恒定律����,這句話是不對的���。因?yàn)樗兂伤魵馐俏锢碜兓?
②質(zhì)量守恒定律一定是指參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和等于反應(yīng)后生成的各物質(zhì)的質(zhì)量總和��。即不能將沒有參加反應(yīng)的質(zhì)量和反應(yīng)后剩余的質(zhì)量計算在內(nèi)�����。
③要注意是“各物質(zhì)”的質(zhì)量總和�����,不能遺漏任一反應(yīng)物或生成物��,尤其是氣體�。
④反應(yīng)前后���,元
5�����、素種類不變����,同種元素質(zhì)量相等���。
⑤反應(yīng)前后��,原子種類不變���,原子質(zhì)量也不變。
⑥反應(yīng)前后�����,分子種類一定改變�����,分子數(shù)目不一定改變�����。
二、化學(xué)方程式
1.定義
用化學(xué)式來表示化學(xué)反應(yīng)的式子叫做化學(xué)方程式�。
CuO+H2Cu+H2O
CuO+MgCu+MgO
要點(diǎn)提示
通過化學(xué)方程式,能夠看出反應(yīng)物和生成物���,以及反應(yīng)條件���,還能體現(xiàn)反應(yīng)物和生成物各物質(zhì)間的質(zhì)量關(guān)系,以及發(fā)生反應(yīng)的物質(zhì)間的粒子個數(shù)比�,也符合質(zhì)量守恒定律。
2.化學(xué)方程式提供的信息
(1)哪些物質(zhì)參加了反應(yīng)(反應(yīng)物)��。
(2)生成了哪些物質(zhì)(生成物)��。
(3)反應(yīng)條件�����。
(4)反應(yīng)物與生成物之間的質(zhì)量比�。
(
6、5)反應(yīng)物與生成物之間的粒子數(shù)量比�。
(6)反應(yīng)前后質(zhì)量守恒等等。
3.化學(xué)方程式表示的意義
意義
實(shí)例
C+O2CO2
表示反應(yīng)物��、生成物以及反應(yīng)條件。
反應(yīng)物是碳和氧氣���,生成物是二氧化碳��,反應(yīng)條件是點(diǎn)燃�。
表示反應(yīng)物�����、生成物各物質(zhì)之間的質(zhì)量關(guān)系���,即質(zhì)量比。
C + O2CO2
12∶16×2 ∶ 44
12∶ 32 ∶ 44
3 ∶ 8 ∶ 11
表示反應(yīng)物�����、生成物之間的粒子數(shù)關(guān)系(粒子個數(shù)比)�����。
C+O2CO2
1∶1 ∶ 1
4.化學(xué)方程式的讀法���。以C+O2CO2為例���。
化學(xué)方程式的讀法從宏觀和微觀兩個方面來讀���。宏觀又從質(zhì)和量兩個方面來讀,微觀從粒
7�、子的個數(shù)來讀。以C+O2=CO2為例���。
①質(zhì)的方面:碳和氧氣在點(diǎn)燃的條件下生成二氧化碳�����。
②量的方面:每12份質(zhì)量的碳和32份質(zhì)量的氧氣��,在點(diǎn)燃的條件下完全反應(yīng)��,生成44份質(zhì)量的二氧化碳���。
③粒子方面:一個碳原子和一個氧分子在點(diǎn)燃的條件下完全反應(yīng)生成一個二氧化碳分子。
問題·思路·探究
問題1在實(shí)際操作過程中��,常常遇到反應(yīng)物的質(zhì)量和生成物的質(zhì)量不相等的情況�����,于是有的同學(xué)認(rèn)為部分化學(xué)反應(yīng)不遵循質(zhì)量守恒定律,對嗎�����?
思路:解決這一疑點(diǎn)�����,必須全面理解質(zhì)量守恒定律���。有這樣兩點(diǎn)值得注意:
(1)找全生成物:很多化學(xué)反應(yīng)有氣體生成�����,定律中“生成的各物質(zhì)的質(zhì)量總和”包括氣體,不能因?yàn)樯闪藲怏w
8�、而誤認(rèn)為質(zhì)量減少,不符合質(zhì)量守恒定律�����。
(2)找全反應(yīng)物:有些反應(yīng)有氣體參與���,定律中“參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和”包括氣體的質(zhì)量���,忘記的話���,往往會誤認(rèn)為反應(yīng)后物質(zhì)的質(zhì)量增加了。
注意到這兩點(diǎn)��,就很容易解釋實(shí)驗(yàn)中遇到的反應(yīng)物的質(zhì)量和生成物的質(zhì)量不相等的情況了�。
探究:不對,所有的化學(xué)反應(yīng)都遵循質(zhì)量守恒定律�。
典題·熱題·新題
例1下列對質(zhì)量守恒定律的理解正確的是 ( ?�。?
A.根據(jù)質(zhì)量守恒定律可知10 g碳和10 g氧氣完全反應(yīng)生成20 g二氧化碳
B.鋁條燃燒后增加的質(zhì)量等于參加反應(yīng)的氧氣的質(zhì)量
C.10 g高錳酸鉀完全分解所得各生成物的質(zhì)量
9���、總和一定是10 g
D.蒸發(fā)液態(tài)空氣所得各氣體的質(zhì)量總和等于液態(tài)空氣的質(zhì)量��,這有力地證實(shí)了質(zhì)量守恒定律
思路解析:A選項(xiàng)是對“參加反應(yīng)”四字理解不透���,10 g碳與10 g氧氣反應(yīng)時�,碳并沒有全部參加反應(yīng)���,而是僅有一部分反應(yīng),還有一些未反應(yīng)����,因而生成的二氧化碳的質(zhì)量應(yīng)小于20 g���。B選項(xiàng)中鋁條燃燒是鋁和空氣中的氧氣反應(yīng)生成氧化鋁��,根據(jù)質(zhì)量守恒定律,鋁條燃燒后增加的質(zhì)量一定等于參加反應(yīng)的氧氣的質(zhì)量���,故B選項(xiàng)正確���。C選項(xiàng)中高錳酸鉀完全分解生成三種物質(zhì),是分解反應(yīng)���,因此�����,10 g高錳酸鉀完全分解所得各生成物的質(zhì)量總和一定是10 g�����,故C選項(xiàng)正確����。D選項(xiàng)是物理變化�����,而質(zhì)量守恒定律適用于化學(xué)變化。
10、答案:BC
深化升華
質(zhì)量守恒定律是指參加反應(yīng)的各物質(zhì)的質(zhì)量總和與反應(yīng)后生成的各物質(zhì)的質(zhì)量總和相等。理解概念時要注意“參加反應(yīng)”“之和”等關(guān)鍵字詞。
例2某物質(zhì)在空氣中完全燃燒只生成二氧化碳和水,則該物質(zhì)中 ?��。ā �����。?
A.只含有碳元素
B.只含有碳���、氫元素
C.一定含有碳、氫����、氧三種元素
D.一定含有碳、氫元素�����,可能含有氧元素
思路解析:由題給信息該反應(yīng)可表示為:某物質(zhì)+氧氣二氧化碳+水���,根據(jù)化學(xué)反應(yīng)前后元素的種類不變����,生成物中含有碳��、氫����、氧三種元素��,則反應(yīng)物中也必定含有碳��、氫�、氧三種元素�,又因?yàn)榉磻?yīng)物中已經(jīng)有氧氣,所以�����,該物質(zhì)中一定含有碳、氫兩種元素����,可能含有氧元
11、素。
答案:D
深化升華
本題一方面要注意質(zhì)量守恒�,同時還要考慮反應(yīng)物中有氧參加��,所以該物質(zhì)中可能含有氧元素�����,也可能不含有氧元素���。
例3對化學(xué)方程式2CO+O22CO2的讀法或敘述正確的是 ( ?���。?
A.一氧化碳加氧氣點(diǎn)燃等于二氧化碳
B.一氧化碳與氧氣在點(diǎn)燃條件下生成二氧化碳
C.反應(yīng)中CO、O2�、CO2的質(zhì)量比為28∶32∶44
D.2個一氧化碳分子加1個氧分子等于2個二氧化碳分子
思路解析:表述化學(xué)方程式時���,兩物質(zhì)間的“+”讀成“和”或“與”而不是數(shù)學(xué)符號中的加號,“”表示生成的意思�����。故A、D選項(xiàng)錯誤����?���;瘜W(xué)方程式反映物質(zhì)間質(zhì)量比是建立在質(zhì)量守恒定律基礎(chǔ)上的
12���、,必須是物質(zhì)相對分子質(zhì)量與前面化學(xué)計量數(shù)乘積之比�����,CO�����、O2����、CO2的質(zhì)量比應(yīng)為56∶32∶88����。
答案:B
深化升華
化學(xué)方程式表示的意義及其讀法是化學(xué)的最基本內(nèi)容,化學(xué)的特點(diǎn)就是用符號來表達(dá)一定的含義�����。通過一個化學(xué)方程式我們可以獲得很多信息,如反應(yīng)物之間的分子個數(shù)比�����,各種反應(yīng)物以及生成物的質(zhì)量比等���。
例4 已知反應(yīng):2A+5O24CO2+2H2O�����,則A的化學(xué)式為 ( ?。?
A.C2H4 B.C4H4 C.C2H2 D.C4H2O
思路解析:在化學(xué)反應(yīng)前后����,原子的種類、數(shù)目沒有發(fā)生變化���。
2A+5O24CO2+2H2O
由上式可以看出���,反應(yīng)后一共含有4個碳原子、4個氫原子和10個氧原子�,反應(yīng)前已經(jīng)含有10個氧原子��,所以2A中一定含有4個碳原子�、4個氫原子�。因此A中一定含有2個碳原子、2個氫原子���,故A的分子式為C2H2����。
答案:C
深化升華
此題實(shí)際是質(zhì)量守恒定律的應(yīng)用�����,根據(jù)方程式左邊所含原子總數(shù)與方程式右邊所含原子總數(shù)相等�����,即可解得�����。
 2020年中考化學(xué)總復(fù)習(xí)教學(xué)案 第五單元課題1 質(zhì)量守恒定律
2020年中考化學(xué)總復(fù)習(xí)教學(xué)案 第五單元課題1 質(zhì)量守恒定律