《人教版化學(xué)九年級(jí)下冊(cè) 10.2 pH與中和反應(yīng) 學(xué)案》由會(huì)員分享��,可在線閱讀���,更多相關(guān)《人教版化學(xué)九年級(jí)下冊(cè) 10.2 pH與中和反應(yīng) 學(xué)案(3頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索����。
1�����、實(shí)驗(yàn)專題(二) pH與中和反應(yīng)
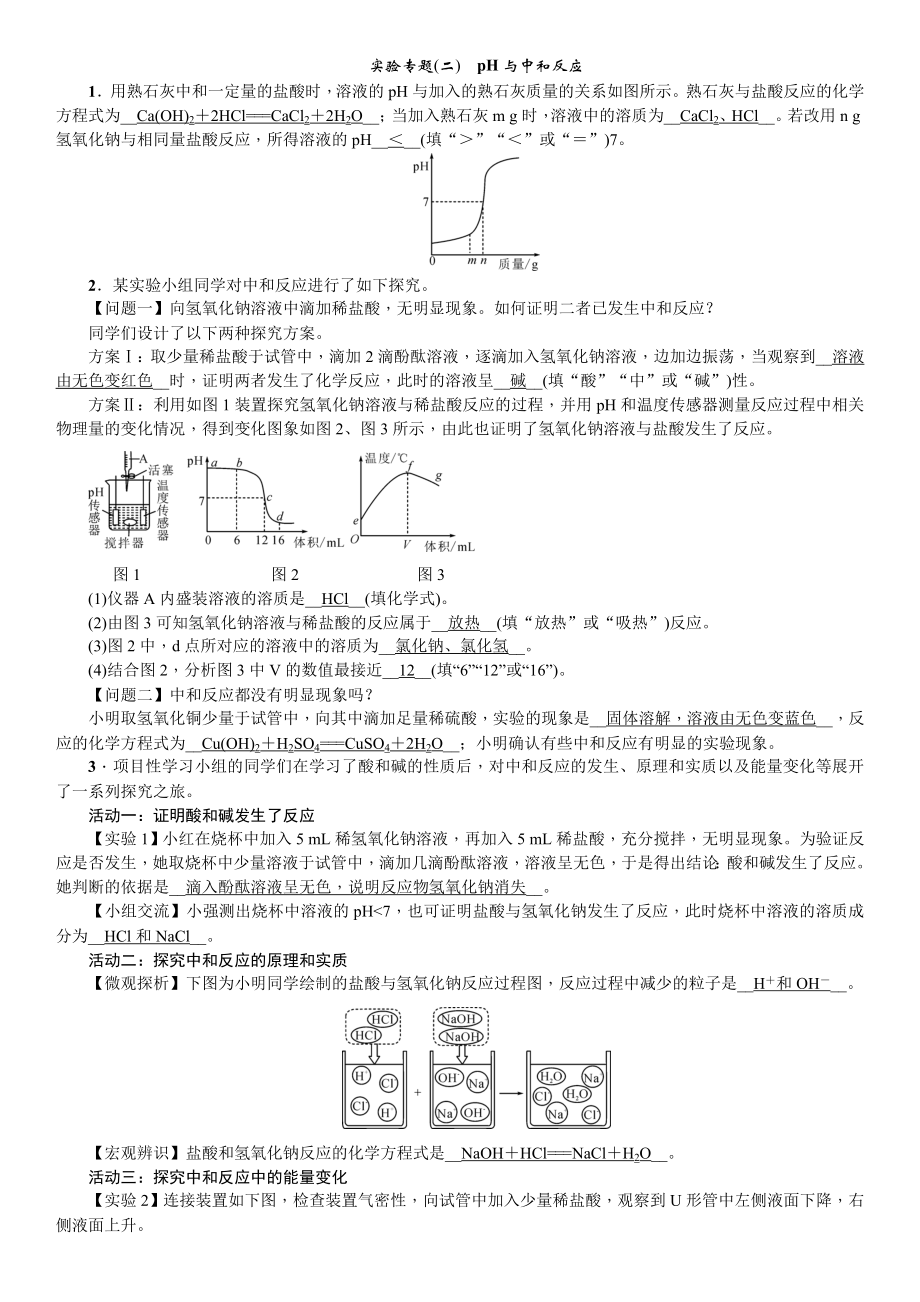
1.用熟石灰中和一定量的鹽酸時(shí)��,溶液的pH與加入的熟石灰質(zhì)量的關(guān)系如圖所示��。熟石灰與鹽酸反應(yīng)的化學(xué)方程式為_(kāi)_Ca(OH)2+2HCl===CaCl2+2H2O__�;當(dāng)加入熟石灰m g時(shí)�����,溶液中的溶質(zhì)為_(kāi)_CaCl2�����、HCl__。若改用n g氫氧化鈉與相同量鹽酸反應(yīng)���,所得溶液的pH__<__(填“>”“<”或“=”)7���。
2.某實(shí)驗(yàn)小組同學(xué)對(duì)中和反應(yīng)進(jìn)行了如下探究。
【問(wèn)題一】向氫氧化鈉溶液中滴加稀鹽酸���,無(wú)明顯現(xiàn)象��。如何證明二者已發(fā)生中和反應(yīng)�����?
同學(xué)們?cè)O(shè)計(jì)了以下兩種探究方案�。
方案Ⅰ:取少量稀鹽酸于試管中���,滴加2滴酚酞溶液�,逐滴加入氫氧化鈉溶液��,邊
2�、加邊振蕩�����,當(dāng)觀察到__溶液由無(wú)色變紅色__時(shí)���,證明兩者發(fā)生了化學(xué)反應(yīng),此時(shí)的溶液呈__堿__(填“酸”“中”或“堿”)性�。
方案Ⅱ:利用如圖1裝置探究氫氧化鈉溶液與稀鹽酸反應(yīng)的過(guò)程,并用pH和溫度傳感器測(cè)量反應(yīng)過(guò)程中相關(guān)物理量的變化情況�����,得到變化圖象如圖2�����、圖3所示����,由此也證明了氫氧化鈉溶液與鹽酸發(fā)生了反應(yīng)。
圖1 圖2 圖3
(1)儀器A內(nèi)盛裝溶液的溶質(zhì)是__HCl__(填化學(xué)式)�����?����!?
(2)由圖3可知?dú)溲趸c溶液與稀鹽酸的反應(yīng)屬于__放熱__(填“放熱”或“吸熱”)反應(yīng)����。
(3)圖2中,d點(diǎn)所對(duì)應(yīng)的溶液中的溶質(zhì)為_(kāi)_氯化鈉���、氯化氫__����。
(4
3���、)結(jié)合圖2��,分析圖3中V的數(shù)值最接近__12__(填“6”“12”或“16”)�。
【問(wèn)題二】中和反應(yīng)都沒(méi)有明顯現(xiàn)象嗎�����?
小明取氫氧化銅少量于試管中�����,向其中滴加足量稀硫酸,實(shí)驗(yàn)的現(xiàn)象是__固體溶解����,溶液由無(wú)色變藍(lán)色__,反應(yīng)的化學(xué)方程式為_(kāi)_Cu(OH)2+H2SO4===CuSO4+2H2O__��;小明確認(rèn)有些中和反應(yīng)有明顯的實(shí)驗(yàn)現(xiàn)象��。
3.項(xiàng)目性學(xué)習(xí)小組的同學(xué)們?cè)趯W(xué)習(xí)了酸和堿的性質(zhì)后���,對(duì)中和反應(yīng)的發(fā)生��、原理和實(shí)質(zhì)以及能量變化等展開(kāi)了一系列探究之旅���。
活動(dòng)一:證明酸和堿發(fā)生了反應(yīng)
【實(shí)驗(yàn)1】小紅在燒杯中加入5 mL稀氫氧化鈉溶液���,再加入5 mL稀鹽酸��,充分?jǐn)嚢?�,無(wú)明顯現(xiàn)象��。為驗(yàn)證反應(yīng)是
4�����、否發(fā)生�����,她取燒杯中少量溶液于試管中���,滴加幾滴酚酞溶液,溶液呈無(wú)色���,于是得出結(jié)論:酸和堿發(fā)生了反應(yīng)����。她判斷的依據(jù)是__滴入酚酞溶液呈無(wú)色�,說(shuō)明反應(yīng)物氫氧化鈉消失__。
【小組交流】小強(qiáng)測(cè)出燒杯中溶液的pH<7����,也可證明鹽酸與氫氧化鈉發(fā)生了反應(yīng),此時(shí)燒杯中溶液的溶質(zhì)成分為_(kāi)_HCl和NaCl__�����。
活動(dòng)二:探究中和反應(yīng)的原理和實(shí)質(zhì)
【微觀探析】下圖為小明同學(xué)繪制的鹽酸與氫氧化鈉反應(yīng)過(guò)程圖,反應(yīng)過(guò)程中減少的粒子是__H+和OH-__�����。
【宏觀辨識(shí)】鹽酸和氫氧化鈉反應(yīng)的化學(xué)方程式是__NaOH+HCl===NaCl+H2O__��。
活動(dòng)三:探究中和反應(yīng)中的能量變化
【實(shí)驗(yàn)2】連接裝置如下
5����、圖,檢查裝置氣密性���,向試管中加入少量稀鹽酸��,觀察到U形管中左側(cè)液面下降�����,右側(cè)液面上升���。
【實(shí)驗(yàn)結(jié)論】__酸和堿的中和反應(yīng)放熱__。
【交流研討】左側(cè)液面下降�,右側(cè)液面上升的原因是__錐形瓶?jī)?nèi)溫度升高���,壓強(qiáng)變大(合理即可)__。
【總結(jié)提升】
(1)要使上述中和反應(yīng)所得溶液呈中性��,實(shí)驗(yàn)操作步驟為:在燒杯中加入5 mL稀氫氧化鈉溶液��,__滴入幾滴酚酞溶液��,再用滴管慢慢滴入稀鹽酸���,并不斷攪拌,至溶液恰好變?yōu)闊o(wú)色為止__�����。
(2)寫(xiě)出中和反應(yīng)在生活或工農(nóng)業(yè)生產(chǎn)中的一點(diǎn)應(yīng)用:__用熟石灰改良酸性土壤(或用稀硫酸中和堿性廢水或用堿性物質(zhì)治療胃酸過(guò)多癥或蚊蟲(chóng)叮咬涂堿性物質(zhì)減輕痛癢等��,合理即可)
6�、__。
4.中和反應(yīng)在工農(nóng)業(yè)生產(chǎn)和生活中有廣泛的應(yīng)用�����。某化學(xué)實(shí)驗(yàn)小組的同學(xué)對(duì)酸堿中和反應(yīng)進(jìn)行了如下探究�。小組同學(xué)設(shè)計(jì)如圖所示的實(shí)驗(yàn)���,驗(yàn)證稀H2SO4與NaOH溶液混合后,發(fā)生了化學(xué)反應(yīng)�����。
(1)用膠頭滴管滴入稀硫酸�����,能證明乙中發(fā)生反應(yīng)的現(xiàn)象是__溶液由紅色變?yōu)闊o(wú)色__���,發(fā)生反應(yīng)的化學(xué)方程式為_(kāi)_2NaOH+H2SO4===Na2SO4+2H2O__����。
(2)有同學(xué)提出也可以使用石蕊溶液代替酚酞溶液進(jìn)行(1)的實(shí)驗(yàn)����。你認(rèn)為_(kāi)_酚酞溶液__(填“酚酞溶液”或“石蕊溶液”)更適合用于驗(yàn)證稀硫酸與氫氧化鈉溶液發(fā)生中和反應(yīng),你的理由是__石蕊溶液在堿性溶液中呈藍(lán)色�����,在中性溶液中呈紫色����,顏色變化
7��、不明顯__�����。
(3)實(shí)驗(yàn)后小明對(duì)燒杯內(nèi)的溶液中的稀硫酸是否過(guò)量進(jìn)行如下探究��。
實(shí)驗(yàn)步驟
實(shí)驗(yàn)現(xiàn)象
實(shí)驗(yàn)結(jié)論
取乙中反應(yīng)后的溶液于試管中,向其中加入__鋅粒(或碳酸鈉等)__
__產(chǎn)生大量氣泡__
稀硫酸過(guò)量
【實(shí)驗(yàn)拓展】室溫下�����,某同學(xué)利用圖丙裝置研究將氫氧化鈉溶液慢慢滴加到盛有稀硫酸的燒杯中���,并用溫度傳感器測(cè)量反應(yīng)過(guò)程中溶液溫度隨時(shí)間的變化曲線如圖丁所示:
(4)該曲線B點(diǎn)后溶液溫度逐漸下降的原因是__過(guò)量的氫氧化鈉溶液起到冷卻的作用__��。
(5)B到A點(diǎn)的過(guò)程中溶液的pH逐漸__增大__(填“增大”“減小”或“無(wú)變化”)�。
5.小亮在做“鹽酸中和氫氧化鈉溶液”的
8�、實(shí)驗(yàn)時(shí),滴加鹽酸前忘了加入指示劑�,導(dǎo)致無(wú)法判斷該中和反應(yīng)進(jìn)行的程度。于是他對(duì)所得溶液的酸堿性進(jìn)行探究�����。
【探究目的】探究所得溶液的酸堿性
(1)【提出猜想】所得溶液可能呈堿性,也可能呈__酸__性���,還可能呈__中__性��。
(2)【實(shí)驗(yàn)驗(yàn)證】
實(shí)驗(yàn)操作
實(shí)驗(yàn)現(xiàn)象
結(jié)論
用試管取該溶液1~2 mL�,滴入1~2滴無(wú)色酚酞溶液���,振蕩
無(wú)色酚酞溶液變__紅__
溶液呈堿性
無(wú)色酚酞溶液不變色
溶液不呈__堿性__
(3)【分析與思考】
①若溶液呈堿性��,則溶液中使其呈堿性的離子是__OH-__(填微粒符號(hào))�,為避免堿性溶液污染環(huán)境�,小亮對(duì)所得溶液進(jìn)行了如下處理:向溶液中逐滴加入_
9、_氯化銅(合理即可)__溶液����,直到不再產(chǎn)生沉淀為止。然后過(guò)濾�����,把濾液倒入蒸發(fā)皿中加熱,得到氯化鈉晶體���,該過(guò)程涉及的化學(xué)方程式為_(kāi)_CuCl2+2NaOH===Cu(OH)2↓+2NaCl__�。
②若無(wú)色酚酞溶液不變色�,為了進(jìn)一步確定溶液的酸堿性,小亮提出了以下方案:
方案一:取樣��,加入碳酸鈣粉末��,若觀察到__有氣泡產(chǎn)生__���,則所取溶液呈酸性����;若無(wú)明顯現(xiàn)象��,則呈中性�。
方案二:取樣�,加入金屬鋅,若有氣泡產(chǎn)生��,則所取溶液呈酸性�����,該反應(yīng)的化學(xué)方程式為_(kāi)_Zn+2HCl===ZnCl2+H2↑__;若無(wú)明顯現(xiàn)象����,則呈中性。
方案三:取樣����,加入紫色石蕊溶液,若觀察到__溶液變紅色__���,則所取溶液呈酸性���;若不變色,則呈中性�����。
 人教版化學(xué)九年級(jí)下冊(cè) 10.2 pH與中和反應(yīng) 學(xué)案
人教版化學(xué)九年級(jí)下冊(cè) 10.2 pH與中和反應(yīng) 學(xué)案