《2021年中考化學(xué)復(fù)習(xí)考點(diǎn)專題測(cè)試:常見的堿中和反應(yīng)》由會(huì)員分享,可在線閱讀����,更多相關(guān)《2021年中考化學(xué)復(fù)習(xí)考點(diǎn)專題測(cè)試:常見的堿中和反應(yīng)(6頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索。
1���、2021年中考化學(xué)復(fù)習(xí)考點(diǎn)專題測(cè)試:常見的堿 中和反應(yīng)
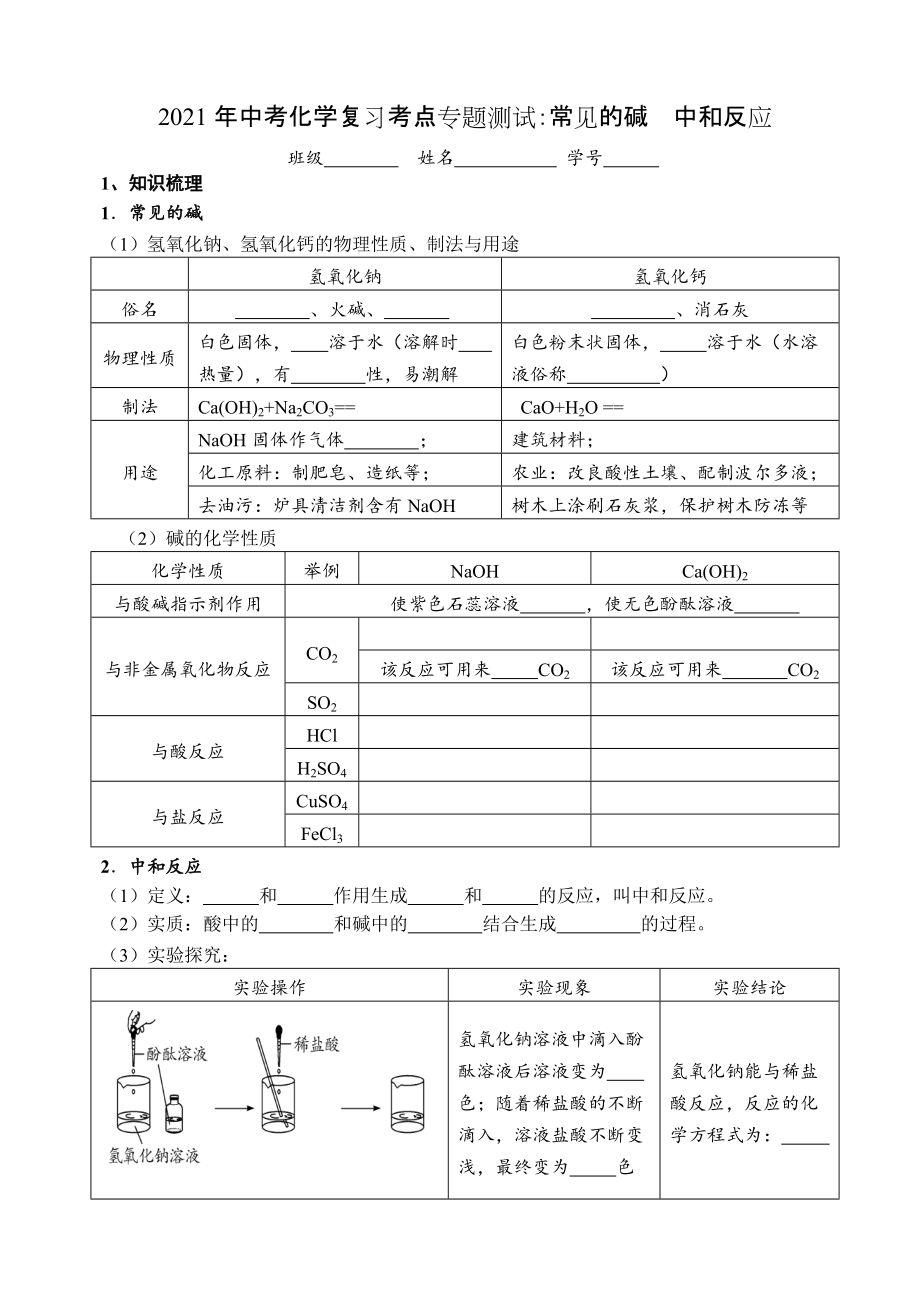
班級(jí) 姓名 學(xué)號(hào)
1��、 知識(shí)梳理
1.常見的堿
(1)氫氧化鈉�����、氫氧化鈣的物理性質(zhì)��、制法與用途
氫氧化鈉
氫氧化鈣
俗名
�����、火堿����、
�����、消石灰
物理性質(zhì)
白色固體, 溶于水(溶解時(shí) 熱量)�,有 性,易潮解
白色粉末狀固體�����, 溶于水(水溶液俗稱 )
制法
Ca(OH)2+Na2CO3==
CaO+H2O ==
用途
NaOH固體作氣體
2��、 ��;
建筑材料�;
化工原料:制肥皂、造紙等����;
農(nóng)業(yè):改良酸性土壤、配制波爾多液�;
去油污:爐具清潔劑含有NaOH
樹木上涂刷石灰漿,保護(hù)樹木防凍等
(2) 堿的化學(xué)性質(zhì)
化學(xué)性質(zhì)
舉例
NaOH
Ca(OH)2
與酸堿指示劑作用
使紫色石蕊溶液 ����,使無色酚酞溶液
與非金屬氧化物反應(yīng)
CO2
該反應(yīng)可用來 CO2
該反應(yīng)可用來 CO2
SO2
與酸反應(yīng)
HCl
H2SO4
與鹽反應(yīng)
CuSO4
FeCl3
2.中和反應(yīng)
(1)定義: 和
3���、 作用生成 和 的反應(yīng)���,叫中和反應(yīng)�。
(2)實(shí)質(zhì):酸中的 和堿中的 結(jié)合生成 的過程����。
(3)實(shí)驗(yàn)探究:
實(shí)驗(yàn)操作
實(shí)驗(yàn)現(xiàn)象
實(shí)驗(yàn)結(jié)論
氫氧化鈉溶液中滴入酚酞溶液后溶液變?yōu)? 色;隨著稀鹽酸的不斷滴入���,溶液鹽酸不斷變淺��,最終變?yōu)? 色
氫氧化鈉能與稀鹽酸反應(yīng)����,反應(yīng)的化學(xué)方程式為:
(4)應(yīng)用:
①調(diào)節(jié)土壤的酸堿性:如通常利用 改良酸性土壤�。
②處理工廠的廢水:如硫酸廠的污水中含有的硫酸可用 等堿性物質(zhì)進(jìn)行
4、處理�。
③用于醫(yī)藥:胃酸過多的病人可以服用胃舒平(含 )的藥物中和過多胃酸。
二�、考點(diǎn)透視
考點(diǎn)1 常見堿的性質(zhì)和用途
例1 下列物質(zhì)不能與NaOH溶液反應(yīng)的是( )
A.二氧化碳 B.硝酸 C.硫酸銅 D.氫氧化鐵
例2 飲食過量����,胃酸會(huì)大量分泌,以致消化不良��。為緩減該癥狀,下列藥劑不適宜的是( ?���。?
A.氫氧化鋁 B.氯化鈉 C.碳酸鎂 D.碳酸氫鈉
例3 忘蓋瓶塞的氫氧化鈉溶液可能變質(zhì)。下表中分析與設(shè)計(jì)錯(cuò)誤的是( ?�。?
選項(xiàng)
問題
分析與設(shè)計(jì)
A
5�、為何變質(zhì)
2NaOH + CO2 = Na2CO3 + H2O
B
是否變質(zhì)
取樣,加入足量稀鹽酸�,觀察是否產(chǎn)生氣泡
C
是否全部變質(zhì)
取樣,加入足量氯化鈣溶液�����,觀察產(chǎn)生沉淀多少
D
如何除去雜質(zhì)
取樣��,加入適量氫氧化鈣溶液�,過濾
例4 某同學(xué)總結(jié)的Ca(OH)2的化學(xué)性質(zhì)如圖,下列說法錯(cuò)誤的是( ?��。?
A.甲一定是碳酸鹽
B.反應(yīng)②為放熱反應(yīng)
C.反應(yīng)③可用于檢驗(yàn)?zāi)撤N溫室氣體
D.向澄清石灰水中加入紫色石蕊試液���,試液由紫色變?yōu)樗{(lán)色
考點(diǎn)2 中和反應(yīng)的實(shí)驗(yàn)探究
例5 科學(xué)探究是學(xué)習(xí)化學(xué)重要而有效的學(xué)習(xí)方法����。某化學(xué)課堂圍繞“酸堿中和反應(yīng)”�����,將學(xué)生分成若干小
6����、組����,在老師引導(dǎo)下開展探究活動(dòng)。以下是教學(xué)片斷����,請(qǐng)你參與學(xué)習(xí)并幫助填寫空格。
活動(dòng)一:甲組同學(xué)向盛有一定量的氫氧化鈉溶液的燒杯中滴加稀鹽酸��,一會(huì)兒后發(fā)現(xiàn)有氣泡產(chǎn)生�����,于是��,他們停止了滴加稀鹽酸��。經(jīng)詢問老師得知該氫氧化鈉溶液已變質(zhì),請(qǐng)你用化學(xué)方程式表示其變質(zhì)的原因 ��。
活動(dòng)二:乙組同學(xué)向盛有一定量的氫氧化鈣溶液的燒杯中滴加稀鹽酸����,一會(huì)兒后發(fā)現(xiàn)忘記了滴加指示劑,因此�����,他們停止了滴加稀鹽酸���,并對(duì)燒杯內(nèi)溶液中溶質(zhì)的成分進(jìn)行探究:
【提出問題】溶液中的溶質(zhì)含有什么物質(zhì)��?
【作出猜想】猜想一:溶質(zhì)只有CaCl2
猜想
7�����、二:溶質(zhì)有CaCl2和Ca(OH)2
猜想三:溶質(zhì)有
【査閱資料】氯化鈣溶液呈中性
【方案設(shè)計(jì)】
方案
方法步驟
實(shí)驗(yàn)現(xiàn)象
實(shí)驗(yàn)結(jié)論
方案一
取少量燒杯內(nèi)的溶液于試管中����,加入無色酚酞溶液
酚酞不變色
猜想一正確
酚酞變紅色
猜想二正確
方案二
取少量燒杯內(nèi)的溶液于試管中�����,加入
猜想三正確
【方案評(píng)價(jià)】小組同學(xué)通過討論后認(rèn)為:
(1)方案一能證明猜想二正確����,但不能證明猜想一正確。
(2)方案二可行���,但小組同學(xué)在記錄時(shí)未記錄完整�����,請(qǐng)你替他們補(bǔ)充完整����。
【方案反思】(1)方案一不能證明
8���、猜想一正確的理由是酚酞在中性和酸性溶液中都不變色����;
(2)某同學(xué)提出將方案一中酚酞溶液換成 (填一種試劑即可)同樣可以得出猜想二正確���。
三����、課堂訓(xùn)練
1.下列關(guān)于Ca(OH)2的說法錯(cuò)誤的是( )
A.微溶于水�����,水溶液呈堿性
B.能與酸反應(yīng)����,可用于治療胃酸過多
C.與CuSO4溶液按一定比例混合,可配制波爾多液
D.澄清溶液可用來檢驗(yàn)CO2
2.能用于鑒別氫氧化鈉溶液和氫氧化鈣溶液的物質(zhì)是( ?����。?
A.HCl B.Na2CO3 C.KNO3 D.FeCl3
3.某同學(xué)將一定量的Na2
9��、CO3與Ba(OH)2溶液混合���,要想檢驗(yàn)反應(yīng)后Ba(OH)2是否過量����,應(yīng)選用的試劑是( ?���。?
A.酚酞 B.CuCl2溶液 C.Na2CO3溶液 D.NaCl溶液
4.實(shí)驗(yàn)小組用傳感器測(cè)定稀鹽酸與NaOH溶液反應(yīng)過程中溫度和pH的變化情況,測(cè)定結(jié)果如下圖所示,下列說法不正確的是( ?���。?
A.反應(yīng)過程中有熱量放出
B.40s時(shí),溶液中溶質(zhì)為HCl和NaCl
C.該實(shí)驗(yàn)中可用氫氧化鈉固體代替氫氧化鈉溶液
D.該實(shí)驗(yàn)是將稀NaOH溶液滴入稀鹽酸
5.復(fù)習(xí)常見的堿的性質(zhì)時(shí)���,在老師引導(dǎo)下同學(xué)們進(jìn)行了歸納,并設(shè)計(jì)了學(xué)案�����。以下是學(xué)案的部分內(nèi)容����,請(qǐng)你完成。
【知識(shí)回
10�����、顧】氫氧化鈉溶液因與空氣中的 (填物質(zhì)化學(xué)式)發(fā)生反應(yīng)易變質(zhì)�,所以必須密封保存。
【舉一反三】Ba(OH)2是一種易溶于水的堿�����,向Ba(OH)2溶液中加入少量液態(tài)三氧化硫,反應(yīng)的化學(xué)方程式是 ����。
【實(shí)驗(yàn)探究一】堿能與酸發(fā)生中和反應(yīng),為探究中和反應(yīng)是否已經(jīng)發(fā)生�,設(shè)計(jì)了如下實(shí)驗(yàn):
(1)向盛有澄清石灰水的燒杯中先滴加幾滴酚酞溶液,再緩慢滴加稀鹽酸����,邊加邊攪拌。當(dāng)觀察到 �,說明中和反應(yīng)已經(jīng)發(fā)生。
(2)向盛有少量石灰乳的燒杯中加入適量稀鹽酸�,并攪拌,觀察到白色渾濁完全消失��,該實(shí)
11�、驗(yàn) (填“能”或“不能”)說明中和反應(yīng)已經(jīng)發(fā)生。
【實(shí)驗(yàn)探究二】向盛有氯化銅溶液的燒杯中加入過量稀氫氧化鈉溶液�����,觀察到 ��,說明堿能與某些鹽發(fā)生反應(yīng)�。
【實(shí)驗(yàn)探究三】在完成實(shí)驗(yàn)探究一�、二后����,將三只燒杯中的所有物質(zhì)倒入廢液缸,最終得到澄清溶液���。該溶液中除酚酞外���,一定含有的溶質(zhì)有 。
【歸納總結(jié)】堿能跟某些非金屬氧化物�、酸��、某些鹽反應(yīng)�����,還能使酸堿指示劑顯色���。
6.如圖所示����,某實(shí)驗(yàn)小組的同學(xué)在進(jìn)行酸堿中和反應(yīng)的實(shí)驗(yàn)時(shí)��,向燒杯中的氫氧化鈉溶液加入稀鹽酸一會(huì)后,發(fā)現(xiàn)忘記了滴加指示劑����。因此,他們停止滴加稀鹽酸��,并對(duì)燒
12��、杯內(nèi)溶液中的溶質(zhì)成分進(jìn)行探究���。
Ⅰ���、從微觀角度分析,中和反應(yīng)的實(shí)質(zhì)是 ��。
Ⅱ����、探究燒杯內(nèi)溶液中溶質(zhì)的成分:
【提出問題】該燒杯內(nèi)溶液中的溶質(zhì)是什么?
【猜想】猜想①:可能是NaCl和NaOH���;
猜想②:可能只有NaCl���;
猜想③:可能是 �。
【查閱資料】氯化鈉溶液呈中性��。
【進(jìn)行實(shí)驗(yàn)】
實(shí)驗(yàn)方案
實(shí)驗(yàn)操作
實(shí)驗(yàn)現(xiàn)象
實(shí)驗(yàn)結(jié)論
方案一
取少量燒杯內(nèi)溶液于試管中���,滴入幾滴酚酞溶液���,振蕩
溶液 色
猜想①不正確
方案二
取少量燒杯內(nèi)溶液于另一支試管中,逐
13���、滴加入碳酸鈉溶液至過量
猜想②不正確���,
猜想③正確
方案二發(fā)生反應(yīng)的化學(xué)方程式是 。
【反思與拓展】
(1)在分析化學(xué)反應(yīng)后所得物質(zhì)成分時(shí)�����,除考慮生成物外還需考慮 ����。
(2)根據(jù)所學(xué)化學(xué)知識(shí)����,驗(yàn)證燒杯內(nèi)溶液中的溶質(zhì)含有HC1���,除以上方案外,下列哪些物質(zhì)單獨(dú)使用也能完成該實(shí)驗(yàn)�����? (填序號(hào))����。
A.pH試紙 B.銅 C.紫色石蕊溶液
答案
1、 知識(shí)梳理
1.(1)
14�����、
氫氧化鈉
氫氧化鈣
俗名
燒堿 �、火堿、 苛性鈉
熟石灰 �、消石灰
物理性質(zhì)
白色固體,易溶于水(溶解時(shí)放出 熱量)����,有 吸水 性,易潮解
白色粉末狀固體�����, 微 溶于水(水溶液俗稱 石灰水 )
制法
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
CaO+H2O == Ca(OH)2
用途
NaOH固體作氣體 干燥劑 ;
建筑材料����;
化工原料:制肥皂、造紙等��;
農(nóng)業(yè):改良酸性土壤���、配制波爾多液�����;
去油污:爐具清潔劑含有NaOH
樹木上涂刷石灰漿����,保護(hù)樹木防凍等
(2)
化學(xué)性質(zhì)
舉例
NaOH
Ca(OH)2
與酸堿指示劑作用
15���、
使紫色石蕊溶液變藍(lán) ,使無色酚酞溶液 變紅
與非金屬氧化物反應(yīng)
CO2
2NaOH+CO2==Na2CO3+H2O
CO2+Ca(OH)2==CaCO3↓+H2O
該反應(yīng)可用來 吸收 CO2
該反應(yīng)可用來 檢驗(yàn) CO2
SO2
2NaOH+SO2==Na2SO3+H2O
SO2+Ca(OH)2==CaSO3↓+H2O
與酸反應(yīng)
HCl
NaOH+HCl==NaCl+H2O
Ca(OH)2+2HCl==CaCl2+2H2O
H2SO4
2NaOH+H2SO4==Na2SO4+2H2O
Ca(OH)2+H2SO4==CaSO4+2H2O
與鹽反應(yīng)
Cu
16��、SO4
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
CuSO4+Ca(OH)2== Cu(OH)2↓+ CaSO4
FeCl3
FeCl3+3NaOH==Fe(OH)3 ↓+3NaCl
2FeCl3+3Ca(OH)2==2Fe(OH)3 ↓+3CaCl2
2.
(1)酸 堿 鹽 水
(2)氫離子 氫氧根離子 水分子
(3)
實(shí)驗(yàn)操作
實(shí)驗(yàn)現(xiàn)象
實(shí)驗(yàn)結(jié)論
氫氧化鈉溶液中滴入酚酞溶液后溶液變?yōu)榧t色�;隨著稀鹽酸的不斷滴入,溶液鹽酸不斷變淺��,最終變?yōu)闊o 色
氫氧化鈉能與稀鹽酸反應(yīng),反應(yīng)的化學(xué)方程式為: NaOH+HCl==NaCl+H2O
17����、(4)
①熟石灰 ②熟石灰 ③Al(OH)3
二、考點(diǎn)透視
例1 D
例2 B
例3 C
例4 A
例5 2NaOH+CO2==Na2CO3+H2O CaCl2和HCl 石蕊試液 溶液變成紅色 MgCl2溶液
三����、課堂訓(xùn)練
1.B
2.B
3.C
4.C
5.CO2 Ba(OH)2+SO3==BaSO4↓+H2O 溶液由紅色變?yōu)闊o色 不能 有藍(lán)色沉淀生成
NaCl、CaCl2�、CuCl2
6. 酸中的氫離子和堿中的氫氧根離子結(jié)合生成水分子 不變 產(chǎn)生氣泡
Na2CO3+2HCl==2NaCl+H2O+CO2↑ 反應(yīng)物是否過量 AC
 2021年中考化學(xué)復(fù)習(xí)考點(diǎn)專題測(cè)試:常見的堿中和反應(yīng)
2021年中考化學(xué)復(fù)習(xí)考點(diǎn)專題測(cè)試:常見的堿中和反應(yīng)