《江蘇省揚(yáng)州市寶應(yīng)縣城鎮(zhèn)中學(xué)高三化學(xué)一輪復(fù)習(xí) 鹽類水解課件》由會(huì)員分享���,可在線閱讀�����,更多相關(guān)《江蘇省揚(yáng)州市寶應(yīng)縣城鎮(zhèn)中學(xué)高三化學(xué)一輪復(fù)習(xí) 鹽類水解課件(14頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索�����。
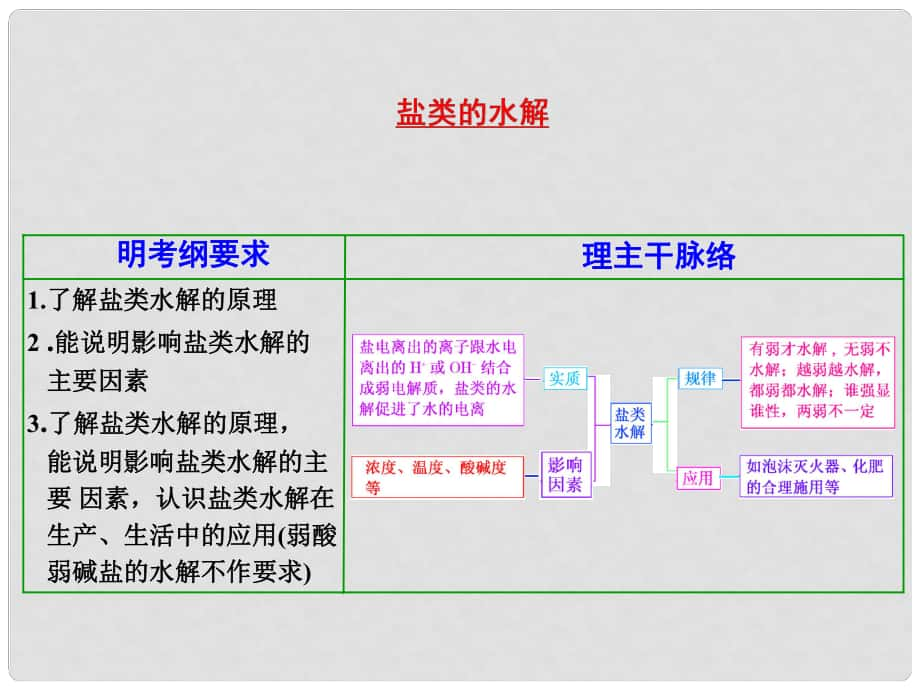
1�����、1.了解鹽類水解的原理了解鹽類水解的原理2 .能說(shuō)明影響鹽類水解的能說(shuō)明影響鹽類水解的 主要因素主要因素3.了解鹽類水解的原理�����,了解鹽類水解的原理�����, 能說(shuō)明影響鹽類水解的主能說(shuō)明影響鹽類水解的主 要要 因素����,認(rèn)識(shí)鹽類水解在因素���,認(rèn)識(shí)鹽類水解在 生產(chǎn)�����、生活中的應(yīng)用生產(chǎn)�����、生活中的應(yīng)用(弱酸弱酸 弱堿鹽的水解不作要求弱堿鹽的水解不作要求) 理主干脈絡(luò)理主干脈絡(luò)明考綱要求明考綱要求水水 H或或OH 弱電解質(zhì)弱電解質(zhì)中和反應(yīng)中和反應(yīng) 放熱放熱 吸熱吸熱7堿性堿性水解水解CH3COONa�����、Na2CO3弱酸弱酸強(qiáng)堿鹽強(qiáng)堿鹽7酸性酸性水解水解NH4Cl���、Cu(NO3)2強(qiáng)酸強(qiáng)酸弱堿鹽弱堿鹽7中性中性不水解不水
2、解NaCl�、KNO3強(qiáng)酸強(qiáng)酸強(qiáng)堿鹽強(qiáng)堿鹽溶液溶液的的pH溶液的溶液的酸堿性酸堿性水解的水解的離子離子是否是否水解水解實(shí)例實(shí)例鹽的鹽的類型類型越弱越弱 減小減小增大增大右移右移減減小小增大增大減小減小右移右移增增大大反應(yīng)反應(yīng)物物濃度濃度增大增大增大增大右移右移升高溫度升高溫度水解產(chǎn)生的離子濃度水解產(chǎn)生的離子濃度水解程度水解程度移動(dòng)方向移動(dòng)方向條件條件增大增大減小減小堿堿減小減小增大增大酸酸弱堿陽(yáng)離子弱堿陽(yáng)離子弱酸陰離子弱酸陰離子水解程度的影響水解程度的影響外加物質(zhì)外加物質(zhì) 的溶液中:的溶液中:Fe2+����、NO3 3�����、SO42 2�����、Na+ B由水電離的由水電離的c(H+)=11014molL1的溶液
3�、中:的溶液中:Ca2+、K+����、Cl、HCO3 Cc(H+)/c(OH)=1012的溶液中:的溶液中:NH4+�����、Al3+����、NO3、Cl Dc(Fe3+)=0.1molL L1 1的溶液中:的溶液中:K+、ClO�����、SO42�、SCN2下列有關(guān)電解質(zhì)溶液中微粒的物質(zhì)的量濃度關(guān)系正確的是下列有關(guān)電解質(zhì)溶液中微粒的物質(zhì)的量濃度關(guān)系正確的是 A在在0.1 molL1NaHCO3溶液中:溶液中:c(Na)c(HCO3)c(CO32)c(H2CO3) B在在0.1 molL1Na2CO3溶液中:溶液中:c(OH)c(H)c(HCO3)2c(H2CO3) C向向0.2 molL1NaHCO3溶液中加入等體積溶液中
4、加入等體積0.1 molL1NaOH溶液:溶液: c(CO32) c(HCO3) c(OH)c(H) D常溫下�,常溫下�����,CH3COONa和和CH3COOH混合溶液混合溶液pH7, c(Na)0.1 molL1:c(Na)c(CH3COO)c(CH3COOH)c(H)c(OH)1常溫下�,下列各組離子在指定溶液中能大量共存的是(常溫下,下列各組離子在指定溶液中能大量共存的是( ) ApH=13四川攀枝花蘊(yùn)藏著豐富的釩�����、鈦���、鐵資源���。用鈦鐵礦渣(主要成分四川攀枝花蘊(yùn)藏著豐富的釩、鈦���、鐵資源�����。用鈦鐵礦渣(主要成分為為TiO2�、FeO、Fe2O3���,Ti的最高化合價(jià)為的最高化合價(jià)為4)做原料�,生成白色顏料二
5���、做原料����,生成白色顏料二氧化鈦的主要步驟如下:氧化鈦的主要步驟如下:濃硫酸鈦鐵礦渣硫酸處理后的礦物水過(guò)濾剩余鐵粉濾液I過(guò)濾濾液控溫過(guò)濾A:FeSO47H2O濾液調(diào)節(jié)pH為0.5過(guò)濾水合二氧化鈦煅燒二氧化鈦加熱鐵粉請(qǐng)回答下列問(wèn)題:請(qǐng)回答下列問(wèn)題:(1)硫酸與二氧化鈦反應(yīng)的化學(xué)方程式是)硫酸與二氧化鈦反應(yīng)的化學(xué)方程式是 �����。(2)向?yàn)V液)向?yàn)V液I中加入鐵粉�,發(fā)生反應(yīng)的離子方程式中加入鐵粉,發(fā)生反應(yīng)的離子方程式為:為: �、 。(3)在實(shí)際生產(chǎn)過(guò)程中���,向沸水中加入濾液)在實(shí)際生產(chǎn)過(guò)程中�,向沸水中加入濾液,使混合液����,使混合液pH達(dá)達(dá)0.5,鈦鹽開始水解���。水解過(guò)程中不斷通入高溫水蒸氣����,維持溶液沸騰一鈦鹽開始水
6�、解�。水解過(guò)程中不斷通入高溫水蒸氣,維持溶液沸騰一段時(shí)間�����,鈦鹽充分水解析出水合二氧化鈦沉淀���。請(qǐng)用所學(xué)化學(xué)平衡段時(shí)間����,鈦鹽充分水解析出水合二氧化鈦沉淀。請(qǐng)用所學(xué)化學(xué)平衡原理分析通入高溫水蒸氣的作用:原理分析通入高溫水蒸氣的作用: ����。過(guò)濾分離出。過(guò)濾分離出水合二氧化鈦沉淀后����,將濾液返回的主要目的是充分利用濾液中的水合二氧化鈦沉淀后,將濾液返回的主要目的是充分利用濾液中的鈦鹽�����、鈦鹽���、 ����、 ����、 (填化學(xué)式),減少?gòu)U物(填化學(xué)式)�����,減少?gòu)U物排放。排放�����。(4)A可用于生成紅色顏料可用于生成紅色顏料(Fe2O3)���,其方法是:將���,其方法是:將556a kg A(摩摩爾質(zhì)量為爾質(zhì)量為278gmol1)溶于水中,加
7����、入適量氫氧化鈉溶液恰好完全溶于水中,加入適量氫氧化鈉溶液恰好完全反應(yīng)�,鼓入足量空氣攪拌�,產(chǎn)生紅褐色膠體;再向紅褐色膠體中加反應(yīng)����,鼓入足量空氣攪拌,產(chǎn)生紅褐色膠體���;再向紅褐色膠體中加入入3336b kg A和和112c kg鐵粉���,鼓入足量空氣攪拌�����,反應(yīng)完成后���,鐵粉,鼓入足量空氣攪拌���,反應(yīng)完成后�,有大量有大量Fe2O3附著在膠體粒子上以沉淀形式析出����;過(guò)濾后,沉淀經(jīng)附著在膠體粒子上以沉淀形式析出���;過(guò)濾后�����,沉淀經(jīng)高溫灼燒得紅色顏料���。若所得濾液中溶質(zhì)只有硫酸鈉和硫酸鐵����,則高溫灼燒得紅色顏料�����。若所得濾液中溶質(zhì)只有硫酸鈉和硫酸鐵���,則理論上可生成紅色顏料理論上可生成紅色顏料 kg����。3. (1)TiO2+2H2SO4=Ti(SO4)2+2H2O或或TiO2+ H2SO4TiOSO4+H2O (2)2Fe3+Fe=3Fe2 Fe+2H=Fe2+H2(3)加水促進(jìn)鈦鹽水解�����,加熱促進(jìn)鈦鹽水解�����,加水促進(jìn)鈦鹽水解���,加熱促進(jìn)鈦鹽水解,降低降低H濃度促進(jìn)鈦鹽水解�����。濃度促進(jìn)鈦鹽水解。H2O FeSO4 H2SO4 (4)160a+320b+160c
 江蘇省揚(yáng)州市寶應(yīng)縣城鎮(zhèn)中學(xué)高三化學(xué)一輪復(fù)習(xí) 鹽類水解課件
江蘇省揚(yáng)州市寶應(yīng)縣城鎮(zhèn)中學(xué)高三化學(xué)一輪復(fù)習(xí) 鹽類水解課件