《2022年高二化學(xué) 第42課時(shí)《第四節(jié) 原電池原理及其應(yīng)用》(四)練習(xí) 新人教版》由會(huì)員分享,可在線閱讀����,更多相關(guān)《2022年高二化學(xué) 第42課時(shí)《第四節(jié) 原電池原理及其應(yīng)用》(四)練習(xí) 新人教版(2頁珍藏版)》請?jiān)谘b配圖網(wǎng)上搜索。
1����、2022年高二化學(xué) 第42課時(shí)《第四節(jié) 原電池原理及其應(yīng)用》(四)練習(xí) 新人教版
1.實(shí)驗(yàn)室用純鋅與稀H2SO4反應(yīng)制H2的反應(yīng)速率慢,下列方法能提高反應(yīng)速率的是 [ ]
A.再加入幾塊鋅 B.加入少量CuO
C.增大硫酸的濃度 D.加入醋酸銅
2.用鋅片����、銅片和AgNO3溶液組成的原電池,正極上發(fā)生的電極反應(yīng)是 [ ]
A.2H++2e-= H2
2����、 B. Zn-2e-= Zn2+
C.2H2O+O2+4e-=4OH- D. Ag++ e-=Ag
3.一個(gè)原電池的總反應(yīng)的離子方程式是Zn+Cu2+= Zn2++Cu,該反應(yīng)的原電池的正確的組成是 [ ]
A
B
C
D
正極
Zn
Cu
Cu
Fe
負(fù)極
Cu
Zn
Zn
Zn
電解質(zhì)溶液
CuCl2
H2SO4
CuSO4
CuCl2
4.鐵釘和碳棒用導(dǎo)線連接后����,浸入0.01mol·L-1的食鹽溶液中����,可能發(fā)生
3����、 [ ]
A.碳棒上放出Cl2 B.碳棒附近產(chǎn)生OH-
C.碳棒上放出O2 D.鐵釘被氧化
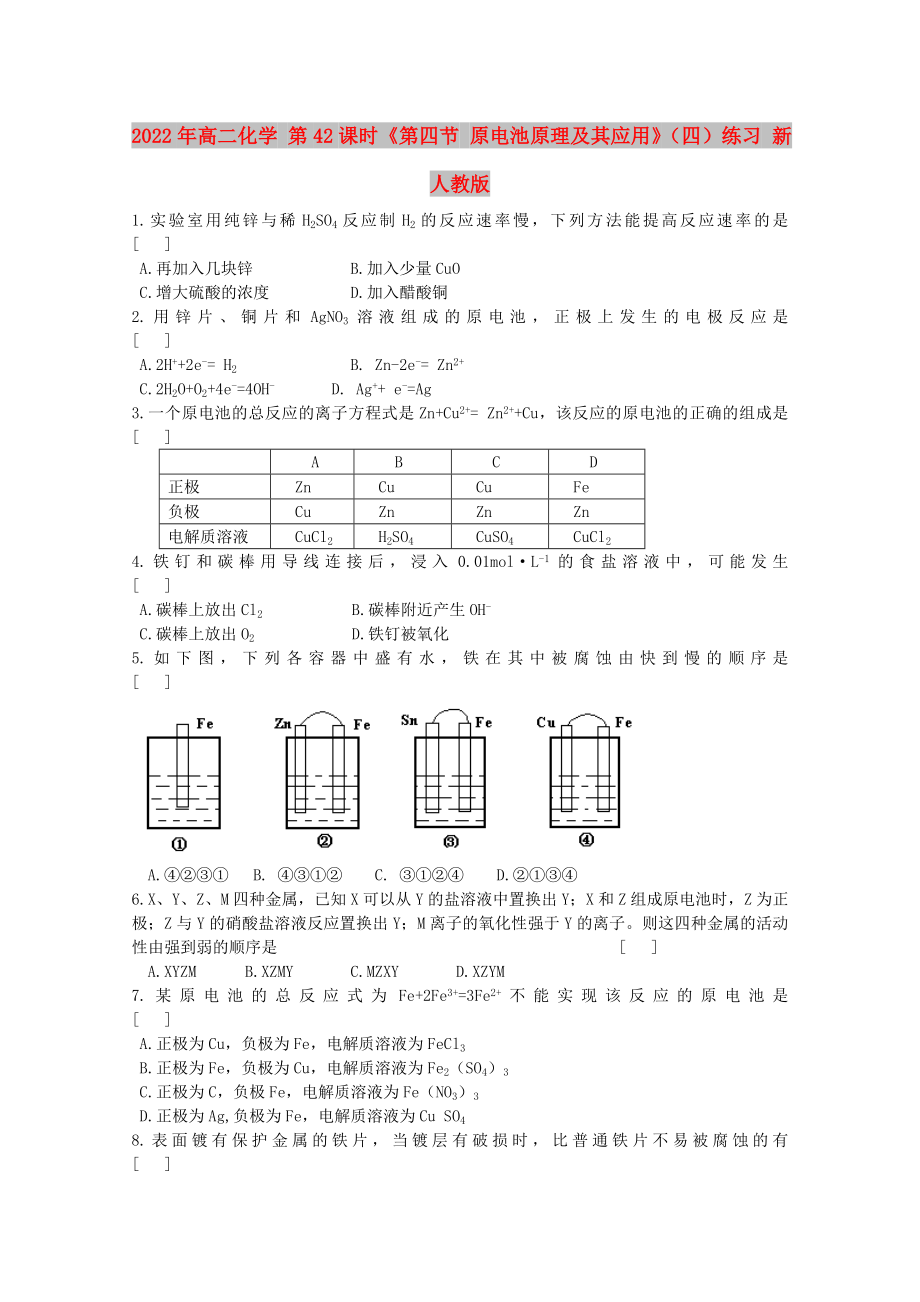
5.如下圖,下列各容器中盛有水����,鐵在其中被腐蝕由快到慢的順序是 [ ]
A.④②③① B. ④③①② C. ③①②④ D.②①③④
6.X、Y����、Z、M四種金屬����,已知X可以從Y的鹽溶液中置換出Y;X和Z組成原電池時(shí)����,Z為正極����;Z與Y的硝酸鹽溶液反應(yīng)
4����、置換出Y����;M離子的氧化性強(qiáng)于Y的離子。則這四種金屬的活動(dòng)性由強(qiáng)到弱的順序是 [ ]
A.XYZM B.XZMY C.MZXY D.XZYM
7.某原電池的總反應(yīng)式為Fe+2Fe3+=3Fe2+不能實(shí)現(xiàn)該反應(yīng)的原電池是 [ ]
A.正極為Cu����,負(fù)極為Fe,電解質(zhì)溶液為FeCl3
B.正極為Fe����,負(fù)極為Cu,電解質(zhì)溶液為Fe2(SO4)3
C.正極為C����,負(fù)極Fe
5、����,電解質(zhì)溶液為Fe(NO3)3
D.正極為Ag,負(fù)極為Fe,電解質(zhì)溶液為Cu SO4
8.表面鍍有保護(hù)金屬的鐵片����,當(dāng)鍍層有破損時(shí)����,比普通鐵片不易被腐蝕的有 [ ]
A.白鐵(鍍鋅鐵) B.馬口鐵(鍍錫鐵)
C.鍍鎳鐵 D.鍍銅鐵
9.埋在地下的輸油鑄鐵管道����,在下列各種情況下,被腐蝕速度最慢的是 [ ]
A. 在含鐵元素較多的酸性土壤里 B.在潮濕疏松
6����、透氣的土壤中
C.在干燥致密不透氣的土壤中
D.在含炭粒較多,潮濕透氣的中性土壤里
10.一種以多孔鉑片做電極����,以KOH溶液為電解質(zhì)溶液的CH4燃料電池中,兩極發(fā)生的電化學(xué)反應(yīng)����;R極;CH4-8e-+10OH-=CO32-+ 7H2O����;S極:2O2+8e-+4H2O= 8 OH-,下列關(guān)于CH4燃料電池的各項(xiàng)敘述中肯定不正確的是 [ ]
A. 通入CH4的R極是電池的正極����,發(fā)生氧化還原反應(yīng);通入O2的S極是電池的負(fù)極����,發(fā)生還原反應(yīng)。
B. 該燃料電池每通入2.8L(STP)CH4時(shí)����,將有1.0mol的電子產(chǎn)生。
C. 該
7����、燃料電池屬于堿性電池,在使用過程中KOH的物質(zhì)的量保持不變����。
D. 該燃料電池在使用過程中,在S極附近的pH將會(huì)升高����。
11.電工操作中擬定,不能把銅線和鋁線擰在一起連接線路����,這是因?yàn)?
12.有A、B兩種金屬分別與鹽酸反應(yīng),產(chǎn)生氫氣的速率接近����。試設(shè)計(jì)一個(gè)實(shí)驗(yàn)證明A、B兩種金屬的活潑性����。
13.將鋅片和碳棒連接,浸入NH4Cl溶液中����,可以產(chǎn)生電流,此時(shí)正極為 ����,電極反應(yīng)式為 ;
負(fù)極為 ����,電極反應(yīng)式為 。
14. Cu放入稀H2SO4����,不溶解,再加Ag2SO4或加入NaNO3����,均見溶液變藍(lán)����,其原因是
����。
 2022年高二化學(xué) 第42課時(shí)《第四節(jié) 原電池原理及其應(yīng)用》(四)練習(xí) 新人教版
2022年高二化學(xué) 第42課時(shí)《第四節(jié) 原電池原理及其應(yīng)用》(四)練習(xí) 新人教版