《高考化學(xué)三輪沖刺 有關(guān)鋁的圖像問題探究導(dǎo)學(xué)案(1).doc》由會員分享����,可在線閱讀,更多相關(guān)《高考化學(xué)三輪沖刺 有關(guān)鋁的圖像問題探究導(dǎo)學(xué)案(1).doc(7頁珍藏版)》請在裝配圖網(wǎng)上搜索�����。
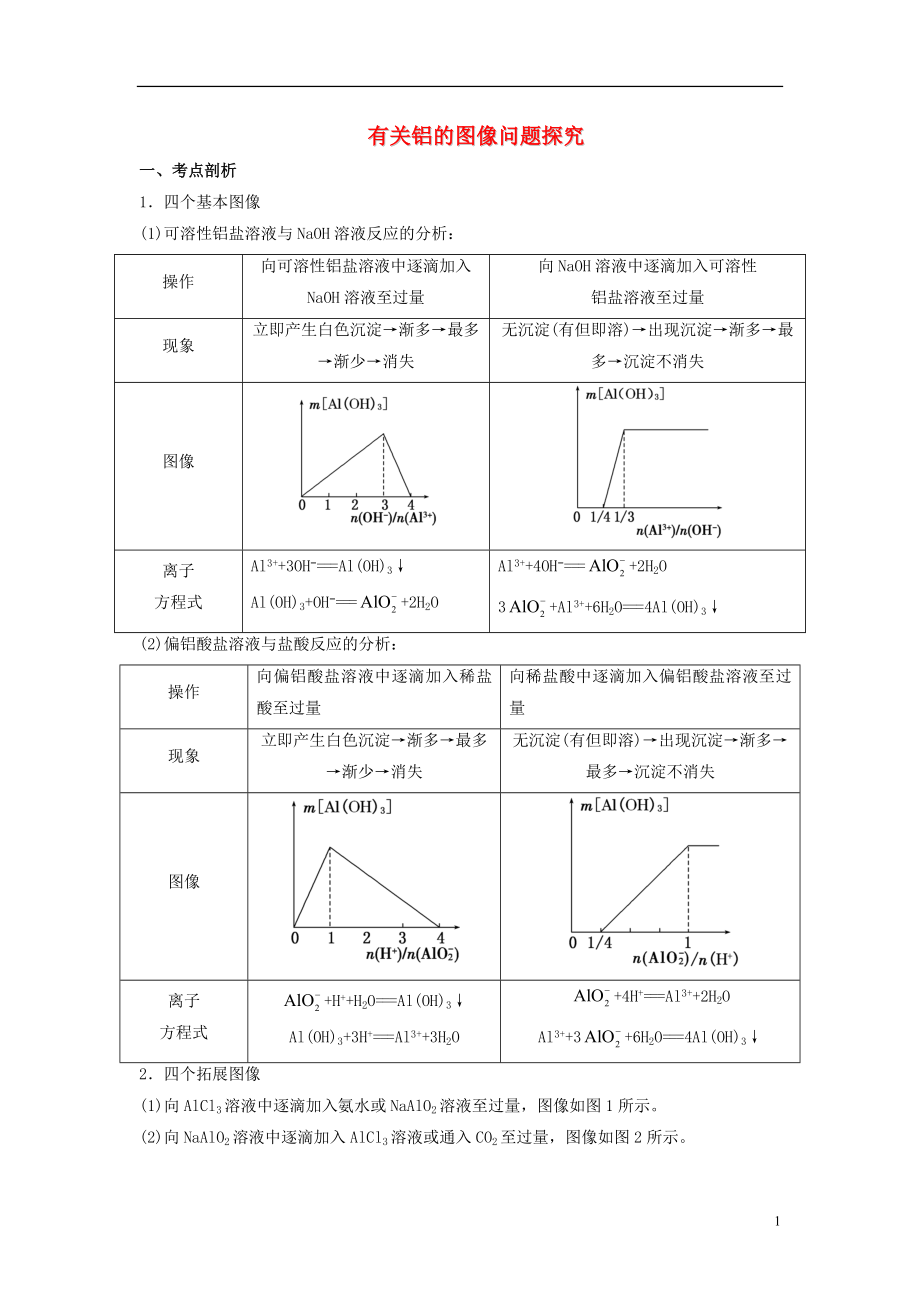
1���、有關(guān)鋁的圖像問題探究一�、考點剖析1四個基本圖像(1)可溶性鋁鹽溶液與NaOH溶液反應(yīng)的分析:操作向可溶性鋁鹽溶液中逐滴加入NaOH溶液至過量向NaOH溶液中逐滴加入可溶性鋁鹽溶液至過量現(xiàn)象立即產(chǎn)生白色沉淀漸多最多漸少消失無沉淀(有但即溶)出現(xiàn)沉淀漸多最多沉淀不消失圖像離子方程式Al3+3OH=Al(OH)3Al(OH)3+OH=+2H2OAl3+4OH=+2H2O3+Al3+6H2O=4Al(OH)3(2)偏鋁酸鹽溶液與鹽酸反應(yīng)的分析:操作向偏鋁酸鹽溶液中逐滴加入稀鹽酸至過量向稀鹽酸中逐滴加入偏鋁酸鹽溶液至過量現(xiàn)象立即產(chǎn)生白色沉淀漸多最多漸少消失無沉淀(有但即溶)出現(xiàn)沉淀漸多最多沉淀不消失圖像
2�、離子方程式+H+H2O=Al(OH)3Al(OH)3+3H+=Al3+3H2O+4H+=Al3+2H2OAl3+3+6H2O=4Al(OH)32四個拓展圖像(1)向AlCl3溶液中逐滴加入氨水或NaAlO2溶液至過量,圖像如圖1所示�����。(2)向NaAlO2溶液中逐滴加入AlCl3溶液或通入CO2至過量���,圖像如圖2所示。圖1 圖2(3)向MgCl2�、AlCl3和鹽酸的混合溶液(即將Mg、Al溶于過量鹽酸所得的溶液)中逐滴滴入NaOH溶液至過量�����,圖像如圖3所示。(4)向MgCl2����、AlCl3混合溶液中先加入NaOH溶液,后加入鹽酸(NaOH與鹽酸的物質(zhì)的量濃度相等)�,沉淀圖像如圖4所示。圖3 圖43
3��、突破Al(OH)3沉淀圖像的三個秘訣(1)明晰橫��、縱坐標(biāo)含義��,然后通過曲線變化特點分析反應(yīng)原理�����。(2)掌握Al3+�����、Al(OH)3�����、三者之間的轉(zhuǎn)化關(guān)系:(3)明晰Al3+溶液中加堿(OH)的幾種常見變形圖像,如:圖A中�����,n(H+)n(Al3+)=21�。圖B中,若已知原溶液中含有Mg2+����。則可推出:n(Mg2+)n(Al3+)=11。圖C中�����,若已知原溶液中含有H+和Mg2+�����,則可推導(dǎo)出:n(H+)n(Al3+)n(Mg2+)=211�����。分析圖像或作圖時不僅要注意加入的酸或堿的強(qiáng)弱���,還要注意加入的量和滴加的順序,因為滴加的順序不同可能產(chǎn)生的現(xiàn)象不同。若產(chǎn)生的沉淀有多種�,應(yīng)仔細(xì)分析相關(guān)量之間的關(guān)系,要
4���、特別注意沉淀是否同步生成�,沉淀是否溶于所加入的過量試劑中�,同時注意縱橫坐標(biāo)的意義。對于一些復(fù)雜問題可先分解后組合��,進(jìn)行圖像的疊加工作�����;只有抓住一些關(guān)鍵點(最高點���、最低點���、轉(zhuǎn)折點等)和變化趨勢,才能順利地解決圖像問題����。【典例】向含MgCl2����、AlCl3均為n mol的混合液中逐滴加入NaOH溶液至過量��,有關(guān)離子沉淀或沉淀溶解與pH關(guān)系如下表:離子Mg2+Al3+物質(zhì)Al(OH)3開始沉淀時的pH8.933.56開始溶解時的pH8.04完全沉淀時的pH10.924.89完全溶解時的pH12.04下列表示生成沉淀與加入NaOH的物質(zhì)的量關(guān)系的圖像中��,關(guān)系正確的是【答案】C【解析】當(dāng)Al3+完全沉淀時
5���、,溶液的pH=8.04����,而鎂離子開始沉淀的pH=8.93,則Al3+完全沉淀時Mg2+還沒有開始沉淀���;即:當(dāng)Mg2+開始沉淀時��,已經(jīng)有部分氫氧化鋁開始溶解�����;鎂離子完全沉淀的pH=10.92�����,氫氧化鋁完全溶解的pH=12.04�,則當(dāng)Mg2+完全沉淀時,氫氧化鋁還沒有完全被溶解�,所以正確的圖象應(yīng)該是C�;答案選C。對點訓(xùn)練1在某無色溶液中緩慢地滴入NaOH溶液直至過量�����,產(chǎn)生沉淀的質(zhì)量與加入的NaOH溶液體積的關(guān)系如圖所示���,由此確定�����,原溶液中含有的陽離子是AMg2+�����、Al3+���、Fe2+ BH+、Mg2+��、Al3+CH+�、Ba2+��、Al3+ D只有Mg2+�����、Al3+【答案】B【解析】A由于是“無色溶液”
6����、����,故一定沒有Fe2+,故A錯誤����;B根據(jù)圖示,先加入氫氧化鈉溶液���,沒有現(xiàn)象��,之后逐漸生成氫氧化鎂��、氫氧化鋁沉淀�,最后氫氧化鋁溶解��,故B正確;C由于圖示中���,一定有不溶于氫氧化鈉的沉淀����,C中離子加入過量氫氧化鈉��,沒有沉淀生成���,故C錯誤;D由于開始是沒有沉淀生成���,B中離子中���,加入氫氧化鈉就會生成沉淀,故D錯誤��。故選B�����。2向Fe2(SO4)3和Al2(SO4)3 的混合溶液中��,逐滴加入NaOH溶液至過量。下列圖象中����,能正確表示上述反應(yīng)的是【答案】D【解析】向Fe2(SO4)3 和Al2(SO4)3 的混合溶液中,逐滴加入NaOH溶液生成氫氧化鐵和氫氧化鋁沉淀�����,氫氧化鈉過量后氫氧化鋁溶解生成偏鋁酸鈉����,氫氧
7、化鐵不溶�����,所以選項D中圖像符合��,答案選D���。3向甲溶液中加入(或通入)乙溶液(或氣體)����,生成的沉淀的量與加入的乙的量的關(guān)系符合如圖的是選項ABCD甲Al2(SO4)3NaAlO2AlCl3Ca(OH)2乙NH3HClNaOHCO2【答案】C【解析】圖象的意義是:隨著乙的不斷加入,反應(yīng)開始?xì)怏w或沉淀逐漸增加����,當(dāng)達(dá)到最大量時,隨著乙的不斷加入�����,反應(yīng)生成的氣體或沉淀逐漸減少直至為0��,并且產(chǎn)生最大量的氣體或者沉淀消耗乙的量是將所有的氣體或沉淀消耗完畢所消耗的量的3倍����。A���、氨氣通入到Al2(SO4)3中�����,會產(chǎn)生白色沉淀��,直到最大量�����,但是氫氧化鋁不溶于氨水中����,沉淀量不會減少,不符合圖象���,A錯誤���;B、1 mo
8�����、l偏鋁酸鈉中加鹽酸時����,產(chǎn)生最大量的氫氧化鋁沉淀消耗鹽酸1 mol,將所有的沉淀消耗完畢所消耗鹽酸的量為3 mol���,前后量之比是13�,不是31���,所以不符合圖象����,B錯誤;C���、氯化鋁和氫氧化鈉反應(yīng)�����,產(chǎn)生最大量的氫氧化鋁沉淀消耗鹽酸3 mol�,將所有的沉淀消耗完畢所消耗鹽酸的量為1 mol���,前后量之比是31��,符合圖象��,C正確;D��、氫氧化鈣與二氧化碳反應(yīng)生成的碳酸鈣沉淀以及碳酸鈣和二氧化碳繼續(xù)反應(yīng)將沉淀消耗完畢的兩個過程中����,消耗的二氧化碳的量之比是11,所以不符合圖象�,D錯誤,答案選C?����!久麕燑c睛】該題涉及知識點較多�,要求學(xué)生有將圖象信息轉(zhuǎn)換為化學(xué)信息的能力,同時對化學(xué)知識必須十分熟練�����,才可能快速解題�。
9、注意掌握圖像的答題技巧:看面:弄清縱����、橫坐標(biāo)的含義?��?淳€:弄清線的變化趨勢�,每條線都代表著一定的化學(xué)反應(yīng)過程���?��?袋c:弄清曲線上拐點的含義�����,如與坐標(biāo)軸的交點���、曲線的交點、折點���、最高點與最低點等��。曲線的拐點代表著一個反應(yīng)過程的結(jié)束和開始�。4向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1 mol/L Ba(OH)2溶液至過量�,加入Ba(OH)2溶液的體積和所得沉淀的物質(zhì)的量的關(guān)系如圖,下列說法不正確的是( )A圖中C點鋁元素存在形式是B向D點溶液中通人CO2氣體��,立即產(chǎn)生白色沉淀C原混合液中cc(AlCl3)=12DOA段反應(yīng)的離子方程式為:3Ba2+2Al3+8OH+3=3BaSO4+2
10����、+4H2O【答案】D【解析】向含Al2(SO4)3和AlCl3的混合溶液與Ba(OH)2溶液反應(yīng)的實質(zhì)是Al3+與OH、Ba2+與之間的離子反應(yīng)�,如下:Ba2+=BaSO4���,Al3+3OH=Al(OH)3�,Al(OH)3+OH=+2H2O,假設(shè)1 mol Al2(SO4)3中完全被沉淀所需Ba(OH)2量為3 mol�����,提供6 mol OH��,1 mol Al2(SO4)3中含有2 mol Al3+�,由反應(yīng)Al3+3OH=Al(OH)3可知,2 mol Al3+完全沉淀���,需要6 mol OH���,故:從起點到A點,可以認(rèn)為是硫酸鋁與氫氧化鋇恰好發(fā)生反應(yīng)生成硫酸鋇�、氫氧化鋁沉淀,A點時完全沉淀�����,AB為氯
11�、化鋁與氫氧化鋇的反應(yīng),B點時溶液中Al3+完全沉淀��,產(chǎn)生沉淀達(dá)最大值���,溶液中溶質(zhì)為BaCl2����,BC為氫氧化鋁與氫氧化鋇反應(yīng),C點時氫氧化鋁完全溶解���。A�����、C點時氫氧化鋁完全溶解��,轉(zhuǎn)化為偏鋁酸鹽�,故C點鋁元素存在形式是,A正確����;B�、D點的溶液中含有Ba2+��、���,通入二氧化碳立即產(chǎn)生碳酸鋇���、氫氧化鋁沉淀����,B正確;C�����、前3 L Ba(OH)2溶液與溶液中Al2(SO4)3反應(yīng)�,從3 L6 L為Ba(OH)2溶液與溶液中AlCl3反應(yīng),二者消耗的氫氧化鋇的物質(zhì)的量相等為3 L1 mol/L=3 mol����,由生成硫酸鋇可知3n= n ,故n=1 mol�����,由氯化鋁與氫氧化鋇生成氫氧化鋁可知3n(AlCl3)=2
12����、n =6 mol,故n(AlCl3)=2 mol���,故原溶液中原混合液中cc(AlCl3)=12,C正確��;D、OA段實質(zhì)為硫酸鋁與氫氧化鋇恰好發(fā)生反應(yīng)生成硫酸鋇����、氫氧化鋁沉淀���,反應(yīng)離子方程式為:3Ba2+2Al3+6OH+3=3BaSO4+2Al(OH)3�,D錯誤���;答案選D���。5把一塊鎂鋁合金投入到20 mL 1 mol/L的HCl溶液里�����,待合金完全溶解后�����,往溶液里加入1 mol/L的NaOH溶液����,生成沉淀的物質(zhì)的量隨加入NaOH溶液體積(mL)變化的關(guān)系如圖所示����。下列說法中正確的是A鎂鋁合金具有很強(qiáng)的抗腐蝕能力,它不溶解在任何酸���、堿或鹽中Bc值越大����,合金中Al的含量越高C b值越大�����,合金中Mg的
13���、含量越高D假設(shè)c=25��,整個實驗過程中���,只發(fā)生了4個離子反應(yīng)【答案】B【解析】A���,鎂鋁合金表面形成致密的氧化膜而具有很強(qiáng)的抗腐蝕能力�,但MgO���、Al2O3����、Mg���、Al都可與H2SO4等反應(yīng)�����,Al、Al2O3也能溶解在NaOH溶液中��,故A錯誤�����;B,根據(jù)圖示,c值越大�,溶解Al (OH)3消耗的NaOH越多,說明合金中Al的含量越高����,故B正確���;C,b點對應(yīng)的沉淀為Al(OH)3和Mg(OH)2的混合物��,溶液中只有氯化鈉����,故b為固定值20 mL�,繼而無法判斷合金中Mg的含量,故C錯誤��;D��,根據(jù)圖示,當(dāng)c=25時�,整個反應(yīng)過程中主要包含Mg��、Al分別與鹽酸的反應(yīng)���,H+與OH的反應(yīng)��,Mg2+���、Al3+分別與OH的反應(yīng),Al(OH)3與OH的反應(yīng)���,主要有6個離子反應(yīng)�,故D錯誤�����。7
 高考化學(xué)三輪沖刺 有關(guān)鋁的圖像問題探究導(dǎo)學(xué)案(1).doc
高考化學(xué)三輪沖刺 有關(guān)鋁的圖像問題探究導(dǎo)學(xué)案(1).doc