《(通用版)高考化學(xué)一輪復(fù)習(xí) 第二章 化學(xué)物質(zhì)及其變化 第6講 實驗探究3 常見離子的檢驗及答題模板-人教版高三化學(xué)試題》由會員分享����,可在線閱讀,更多相關(guān)《(通用版)高考化學(xué)一輪復(fù)習(xí) 第二章 化學(xué)物質(zhì)及其變化 第6講 實驗探究3 常見離子的檢驗及答題模板-人教版高三化學(xué)試題(4頁珍藏版)》請在裝配圖網(wǎng)上搜索�����。
1��、實驗探究3 常見離子的檢驗及答題模板
[教材實驗原型]
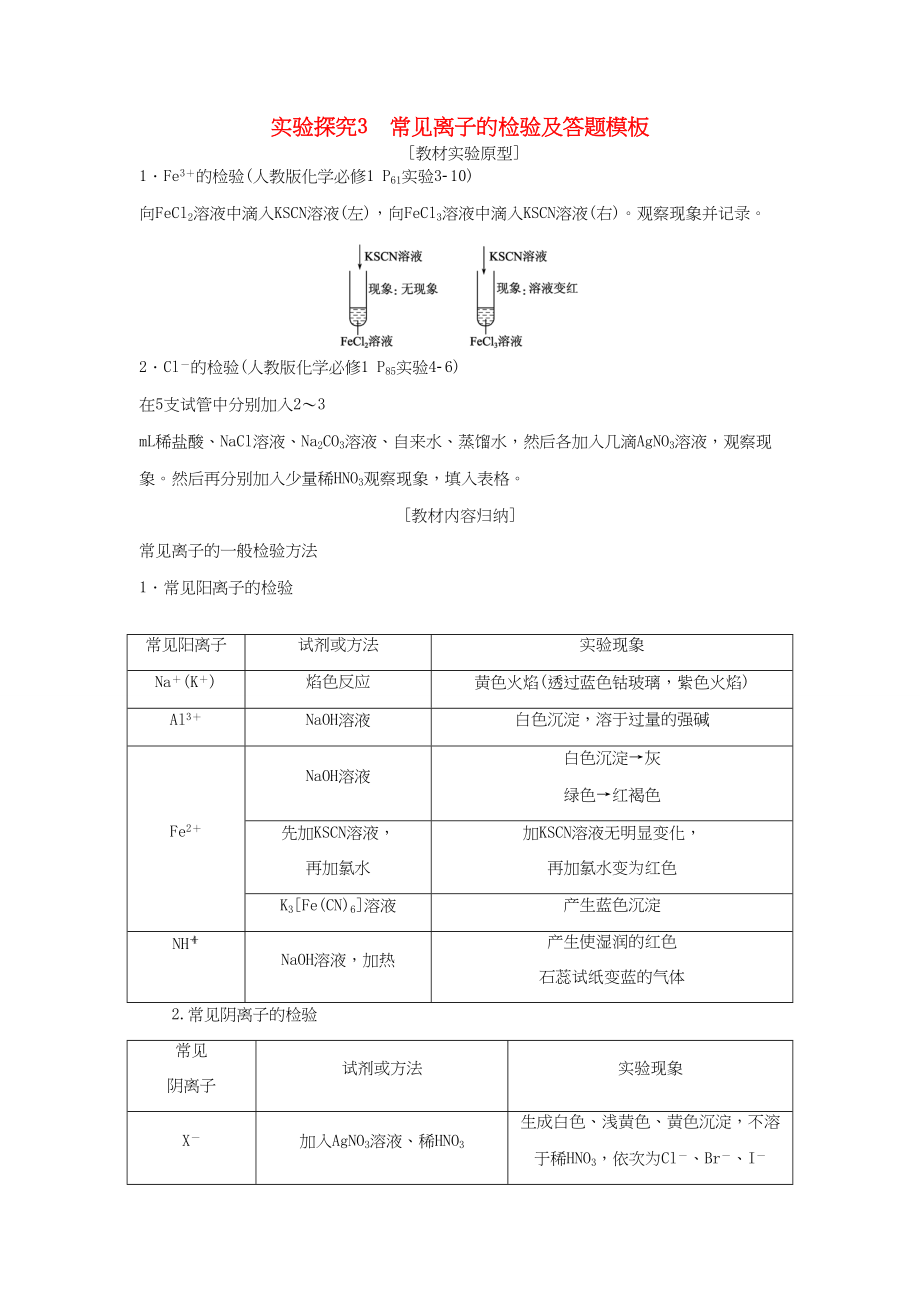
1.Fe3+的檢驗(人教版化學(xué)必修1 P61實驗3-10)
向FeCl2溶液中滴入KSCN溶液(左)��,向FeCl3溶液中滴入KSCN溶液(右)����。觀察現(xiàn)象并記錄。
2.Cl-的檢驗(人教版化學(xué)必修1 P85實驗4-6)
在5支試管中分別加入2~3 mL稀鹽酸����、NaCl溶液、Na2CO3溶液����、自來水、蒸餾水����,然后各加入幾滴AgNO3溶液,觀察現(xiàn)象��。然后再分別加入少量稀HNO3觀察現(xiàn)象��,填入表格��。
[教材內(nèi)容歸納]
常見離子的一般檢驗方法
1.常見陽離子的檢驗
常見陽離子
試劑或方法
實驗現(xiàn)象
Na+(K+)
2����、
焰色反應(yīng)
黃色火焰(透過藍(lán)色鈷玻璃,紫色火焰)
Al3+
NaOH溶液
白色沉淀���,溶于過量的強(qiáng)堿
Fe2+
NaOH溶液
白色沉淀→灰
綠色→紅褐色
先加KSCN溶液�����,
再加氯水
加KSCN溶液無明顯變化�,
再加氯水變?yōu)榧t色
K3[Fe(CN)6]溶液
產(chǎn)生藍(lán)色沉淀
NH
NaOH溶液,加熱
產(chǎn)生使?jié)駶櫟募t色
石蕊試紙變藍(lán)的氣體
2.常見陰離子的檢驗
常見
陰離子
試劑或方法
實驗現(xiàn)象
X-
加入AgNO3溶液��、稀HNO3
生成白色�����、淺黃色����、黃色沉淀,不溶于稀HNO3��,依次為Cl-�����、Br-���、I-
SO
先加入HCl再加入BaCl2溶
3、液
生成白色沉淀(BaSO4)
SO
加入鹽酸或硫酸
產(chǎn)生無色、有刺激性氣味的氣體(SO2)
加BaCl2溶液�����、鹽酸
生成白色沉淀(BaSO3)�����,該沉淀可溶于鹽酸���,產(chǎn)生無色����、有刺激性氣味的氣體(SO2)
注意:當(dāng)有多種離子共存時�����,要注意離子的干擾問題���。
[命題角度探究]
1.檢驗SO時��,為什么使用鹽酸而不使用硝酸���?加入試劑時為什么不能先加入BaCl2溶液后加入鹽酸��?
提示:用硝酸時SO可能干擾�����;先加BaCl2后加鹽酸�����,Ag+干擾�����。
2.怎樣檢驗Fe3+溶液中是否存在Fe2+�����?能否用氯水和KSCN溶液檢驗�?
提示:可以用酸性KMnO4溶液檢驗����;不可以用氯水和KSCN溶液檢
4、驗����。
3.向溶液中加BaCl2溶液��,生成白色沉淀�,再加入稀HNO3�����,白色沉淀不溶解�,能說明溶液中一定含有SO嗎����?為什么?
提示:不能���,Ag+干擾���。
[答題模板評析]
(2014·高考江蘇卷節(jié)選)已知:5SO+2IO+2H+===I2+5SO+H2O
某含碘廢水(pH約為8)中一定存在I2,可能存在I-���、IO中的一種或兩種�。請補充完整檢驗含碘廢水中是否含有I-����、IO的實驗方案:取適量含碘廢水用CCl4多次萃取�����、分液�����,直到水層用淀粉溶液檢驗不出有碘單質(zhì)存在��;
________________________________________________________________
5�����、________�����。(4分)
實驗中可供選擇的試劑:稀鹽酸����、淀粉溶液�����、FeCl3溶液���、Na2SO3溶液����。
[抽樣評析]
失分之鑒
取少量溶液①,加入1~2 mL淀粉溶液②�,滴加FeCl3溶液,若溶液變藍(lán)��,說明廢水中含有I-③�;另取少量溶液���,滴加Na2SO3溶液��,若溶液變藍(lán)�����,說明廢水中含有IO
閱卷點評
①凡是沒有明確指出“從水層取少量溶液”的�����,不得分���;
②凡是沒有明確說明“用鹽酸酸化”的扣2分
③凡是沒有說明“若溶液不變藍(lán)�����,說明廢水中不含有I-”的����,扣1分
滿分答案
從水層取少量溶液��,加入1~2 mL淀粉溶液�����,加鹽酸酸化���,滴加FeCl3溶液�����,若溶液變藍(lán)���,說明廢水中含有I
6、-��;若溶液不變藍(lán),說明廢水中不含有I-��;另從水層取少量溶液���,加入1~2 mL淀粉溶液�,加鹽酸酸化���,滴加Na2SO3溶液�����,若溶液變藍(lán),說明廢水中含有IO��;若溶液不變藍(lán)���,說明廢水中不含有IO
[踩點得分]
四個得分點:明確原理→敘述操作→描述現(xiàn)象→得出結(jié)論
(1)明確原理:依據(jù)題目要求�,明確檢驗的原理�����,根據(jù)原理確定方法��。如I-具有還原性���,需要用氧化劑氧化成I2后用淀粉檢驗���;IO中I為+5價���,具有氧化性,需要用還原劑還原成I2后��,再用淀粉檢驗���;因溶液呈堿性����,I2+2OH-===I-+I(xiàn)O-+H2O��,所以在檢驗之前應(yīng)先用鹽酸酸化���。
(2)敘述操作:取液體(水層少量液體)�、加試劑(如加FeCl3
7�����、溶液、加鹽酸酸化等)����。
(3)描述現(xiàn)象:觀察溶液顏色變化,如何變化要明確具體�。
(4)得出結(jié)論:由什么現(xiàn)象得出對應(yīng)結(jié)論,如“若……說明……��,若……說明……”�。
[答題模板]
離子檢驗的方法
實驗操作(取少量或適量待檢溶液,加入……試劑���,再加入……試劑)
↓
現(xiàn)象描述(①溶液由……變?yōu)椤?�,②若有……生成��,③若沒有……)
↓
得出結(jié)論(如“若……說明……,若……說明……”)
[典題真題體驗]
1.(2016·山東青島模擬)某同學(xué)為檢驗溶液中是否含有常見的幾種無機(jī)離子�,進(jìn)行了如下圖所示的實驗操作,其中檢驗過程中產(chǎn)生的氣體能使?jié)駶櫟募t色石蕊試紙變藍(lán)��。由該實驗?zāi)艿玫降恼_結(jié)論是(
8��、 )
A.原溶液中一定含有SO
B.原溶液中一定含有NH
C.原溶液中一定含有Cl-
D.原溶液中一定含有Fe3+
解析:選B�����。原溶液中加入硝酸鋇和鹽酸生成白色沉淀,原溶液中可能存在SO�、SO或Ag+,A項錯誤�;加硝酸銀溶液產(chǎn)生白色沉淀,可能是加入的鹽酸引起的�,C項錯誤;因檢驗過程中產(chǎn)生的氣體能使?jié)駶櫟募t色石蕊試紙變藍(lán)��,說明原溶液中一定含有NH�,B項正確;加入KSCN溶液得到紅色溶液�����,F(xiàn)e3+可能是由原溶液中的Fe2+被NO���、H+氧化而來的�����,故原溶液中不一定含有Fe3+�,D項錯誤�。
2.(2015·高考四川卷節(jié)選)(NH4)2SO4是常用的化肥和化工原料����,受熱易分解�。某興趣小
9、組擬探究其分解產(chǎn)物��。
【查閱資料】(NH4)2SO4在260 ℃和400 ℃時分解產(chǎn)物不同��。
【實驗探究】該小組擬選用如下圖所示裝置進(jìn)行實驗(夾持和加熱裝置略)��。
連接裝置A—D—B�,檢查氣密性,按圖示重新加入試劑��。通過N2排盡空氣后����,于400 ℃加熱裝置A至(NH4)2SO4完全分解無殘留物,停止加熱��,冷卻�����,停止通入N2���。觀察到裝置A�����、D之間的導(dǎo)氣管內(nèi)有少量白色固體��。經(jīng)檢驗��,該白色固體和裝置D內(nèi)溶液中有SO����,無SO�����。進(jìn)一步研究發(fā)現(xiàn)��,氣體產(chǎn)物中無氮氧化物���。
檢驗裝置D內(nèi)溶液中有SO��、無SO的實驗操作和現(xiàn)象是________________________________________________________________________
________________________________________________________________________���。
答案:取少量裝置D內(nèi)溶液于試管中�,滴加BaCl2溶液����,生成白色沉淀;加入足量稀鹽酸后沉淀完全溶解��,放出無色刺激性氣味的氣體
 (通用版)高考化學(xué)一輪復(fù)習(xí) 第二章 化學(xué)物質(zhì)及其變化 第6講 實驗探究3 常見離子的檢驗及答題模板-人教版高三化學(xué)試題
(通用版)高考化學(xué)一輪復(fù)習(xí) 第二章 化學(xué)物質(zhì)及其變化 第6講 實驗探究3 常見離子的檢驗及答題模板-人教版高三化學(xué)試題